1、实验题 中学教材高中化学第一册有如下图1所示的铜与浓硫酸反应实验装置,该实验过程中会有二氧化硫气体放出,污染室内空气,严重地损害师生健康.为此某课外小组对此实验进行如图2所示的改进,改进的实验操作简单现象明显,并且几乎无二氧化硫气体泄漏。实验步骤如下:
 ?
?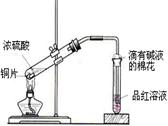
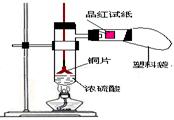
 图1?图2
图1?图2
 ①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
 ②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。
②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。
 回答下列问题:
回答下列问题:
 (1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ?;
(1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ?;
 (2)塑料袋作用是: ;
(2)塑料袋作用是: ;
 (3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是:?;相关的离子方程式是:?。
(3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是:?;相关的离子方程式是:?。
参考答案:(1)支管口有白雾,试管中出现绿色,品红试纸褪色,铜片部分溶解。
 ?(2)收集多余的SO2气体,防止污染空气;
?(2)收集多余的SO2气体,防止污染空气;
 (3)在反应后的试管中、塑料袋中加适量的碱吸收SO2气体?
(3)在反应后的试管中、塑料袋中加适量的碱吸收SO2气体?
 SO2+2OH-
SO2+2OH-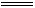 H2O+SO32-或SO2+OH-
H2O+SO32-或SO2+OH-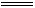 HSO3-
HSO3-

本题解析:当铜片接触热浓硫酸时,有大量的白雾产生(白雾是由于二氧化硫气体与水结合形成亚硫酸小液滴缘故)并沿支管口喷在品红试纸上,使品红试纸的红色开始褪色,而且原来无色硫酸溶液开始变绿,当品红试纸完全褪成白色后,把铜片向上提使其离开浓硫酸溶液,反应马上停止。
本题难度:一般
2、实验题 (9分)某小组同学为探究铜跟浓硫酸的反应情况,并收集一瓶反应产生的气体,设计了如右图所示装置。实验中他们取6.4g铜片与12mL 18mol/L浓硫酸放在圆底烧瓶中加热,直到反应完毕仍发现烧瓶中有铜剩余。

(1)为防止空气污染,请补画右图虚框中的实验装置,并注明所需要的试剂名称。
(2)写出铜跟浓硫酸反应的化学方程式:
?。
(3)该小组认为铜片未完全溶解,则瓶中可能还有一定量的硫酸剩余,其原因是:
?。
(4)为证明反应结束后的烧瓶中确有余酸,可选用下列药品中的?(填写字母序号):
A.铁粉
B.BaCl2溶液
C.银粉
D.Na2CO3溶液
参考答案:

本题解析:(1)为防止空气污染,应有尾气吸收装置,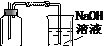
(2)写出铜跟浓硫酸反应的化学方程式:Cu+2H2SO4(浓)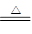 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(3)该小组认为铜片未完全溶解,则瓶中可能还有一定量的硫酸剩余,其原因是:
铜只与浓硫酸反应,随着反应的进行,浓硫酸变为稀硫酸,铜就不在反应,所以,溶液中肯定有稀硫酸存在。
(4)为证明反应结束后的烧瓶中确有余酸,可选用的药品是铁粉、Na2CO3溶液。加入铁粉,如果铁粉溶解并有气泡产生,证明有余酸。加入Na2CO3溶液,如果有气泡产生,证明有余酸。故选A D。
本题难度:简单
3、填空题 请自行设计实验,用至少两种方法证明盐酸的酸性比醋酸的酸性强?
可供选者选择的试剂:0.1mol/L的HCl、0.1mol/L的CH3COOH、0.1mol/L的NaOH、0.1mol/L的CH3COONa、CaCO3粉末、PH试纸、蒸馏水、酚酞试液、石蕊试液、玻璃仪器自行选择.
参考答案:证明盐酸的酸性比醋酸的酸性强的方法有:测定相同浓度醋酸和盐酸溶液的PH值大小;用相同浓度的盐酸和醋酸分别和碳酸钙反应,根据反应速率判断;通过比较体积相同、pH相同的酸溶液同倍数稀释后,溶液的pH变化大小来鉴别等.
实施方法有:
①分别取两张pH试纸放在玻璃片上,用玻璃棒分别蘸取0.1mol/L的HCl和0.1mol/L的CH3COOH测pH,用标准比色卡对照,pH小的为强酸,大的为弱酸.
②取等量碳酸钙粉末于两只试管中,再分别加入等体积的0.1mol/L的HCl和0.1mol/L的CH3COOH,反应较剧烈的为强酸,反应不剧烈的为弱酸.
答:证明盐酸的酸性比醋酸的酸性强的方法为①分别取两张pH试纸放在玻璃片上,用玻璃棒分别蘸取0.1mol/L的HCl和0.1mol/L的CH3COOH测pH,用标准比色卡对照,pH小的为强酸,大的为弱酸;②取等量碳酸钙粉末于两只试管中,再分别加入等体积的0.1mol/L的HCl和0.1mol/L的CH3COOH,反应较剧烈的为强酸,反应不剧烈的为弱酸.
本题解析:
本题难度:一般
4、实验题 (7分)某研究小组为了探究甲烷和氯气反应情况,设计了几个实验。请填写下列空白:
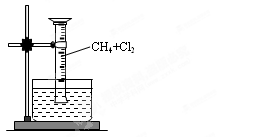
【实验一】用如图所示装置,排水法收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成。
(1)该反应的化学方程式为?(只写第一步);该反应属于?(填反应类型)
(2)水槽中盛放的液体最好为?;(填标号)
A.水
B.饱和石灰水
C.饱和食盐水
D.饱和NaHCO3溶液