1、选择题 关于元素周期表的说法正确的是
A.元素周期表有7个周期
B.元素周期表有8个主族
C.ⅠA族的元素全部是金属元素
D.短周期是指第一、二周期
参考答案:A
本题解析:元素周期表中有7个周期、7个主族;ⅠA族的元素包括氢元素(非金属元素)和碱金属元素;短周期是指第一、二、三周期;综上可知A项正确。
本题难度:简单
2、选择题 下表是部分短周期元素的原子半径及主要化合价,以下叙述正确的是(?)

A.气态氢化物的稳定性为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
参考答案:C
本题解析:根据L、Q的主要化合价为+2价及两者的半径大小关系可知,L、Q分别为ⅡA族的Mg与Be,单质与稀盐酸反应的速率Mg>Be,B错;根据R、T的负价均为-2价和两者的原子半径关系可知,T为O元素,R为S元素,气态氢化物的稳定性H2O>H2S,A错;M的正价为+3价,且原子半径在Mg与S之间,故M为Al,Al2O3具有两性,C对;Mg2+与S2-的核外电子数不相等,D错。
本题难度:一般
3、选择题 短周期元素X、Y、Z、W在周期表中相对位置如下图所示,Y元素在地壳中的含量最高。下列说法正确的是
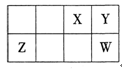
A.原子半径:Z<Y<W
B.最简单气态氢化物的热稳定性:Y<W
C.含X的化合物形成的溶液一定呈酸性
D.Y的最简单阴离子和Z的最简单阳离子核外电子数相同
参考答案:D
本题解析:根据题意知,Y元素在地壳中的含量最高,则Y为氧元素;结合元素在元素周期表中的位置关系判断,X为氮元素,Z为铝元素,W为硫元素。A、根据原子半径比较原则:同周期元素原子半径由左向右逐渐减小,同主族元素原子半径由上到下逐渐增大判断,原子半径:O<S<Al,错误;B、同主族元素气态氢化物的稳定性由上到下逐渐减弱,最简单气态氢化物的热稳定性:S<O,错误;C、含氮化合物形成的溶液不一定呈酸性,如氨气溶于水显碱性,错误;D、O2-和Al3+离子核外电子数相同,均为10,正确。
本题难度:简单
4、选择题 短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素,下列说法正确的是( )
A.原子半径的大小顺序: r(Y)>r(Z)>r(W)
B.元素Z、W的简单离子的电子层结构不同
C.元素Y的简单气态氢化物的热稳定性比Z的强
D.只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物
参考答案:D
本题解析:短周期元素X、Y、Z、W?的原子序数依次增大,Z?是地壳中含量最高的元素,Z为氧元素,X?的原子半径比Y?的小,则X不可能与Y处于同一周期,Y的原子序数小于氧元素,故Y处于第二周期,X处于第一周期,则X为氢元素,X与W同主族,故W为Na元素,四原子最外层电子数之和为13,则Y原子的最外层电子数为13-1-1-6=5,故Y为氮元素。A、同周期自左而右,原子半径减小,同主族自上而下一阵子半径增大,故原子半径Na>N>O,即r(W)>r(Y)>r(Z),错误;B、O2-、Na+离子的核外电子数都是10个电子,核外电子层结构相同,错误;C、同周期自左而右非金属性增强,故非金属性O>N,非金属性越强气态氢化物越稳定,故氢化物稳定性H2O>NH3,错误;D、由H、N、O三元素组成的化合物中,可能是硝酸,为共价化合物,也可能是硝酸铵,为离子化合物,正确。
本题难度:一般
5、填空题
①四种短周期元素中有两种元素在同一主族;
②X的核电荷数比Y少2个;
③五种元素中M的原子序数最小,且核外电子层数和其他元素核外电子层数都不同;?
④五种元素中有两种元素可以形成AB型、A2B3型、A3B4型等多种化合物;
⑤X和Y可以形成XY、XY2等化合物;?
⑥Z和W可以形成WZ、WZ2等化合物;
请回答:






⑴④中AB型、A2B3型、A3B4型化合物的化学式分别是?、?、?。
⑵甲、乙、丙三种常见的可燃气体是由这五种元素中的一种或多种元素组成的。甲、乙、丙燃烧时都发生蓝色或淡蓝色火焰。甲、乙、丙的化学式是?、?、?。
⑶很多反应都可以生成M单质,请写出两个生成M单质反应的化学方程式(要求:参加反应的物质由五种元素中的一种或多种元素组成,反应条件不同于实验室制取M单质的反应条件):?、?。
⑷已知WZ2可以在高温条件下和空气中的氧气反应,1mol WZ2充分反应,放出853kJ的热量,该反应的热化学方程式为?。
参考答案:
⑴FeO? Fe2O3?Fe3O4 ?⑵H2? CO? CH4(无顺序)
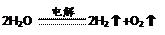
 ?
?
⑶
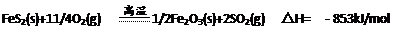 ?
?
⑷






本题解析:由③可假设M为H;由④可知AB、A2B3、A3B4应为FeO? Fe2O3?Fe3O4,该五种元素中有Fe和O;由②⑤可知X为C,Y为O,则W、Z必有一种为Fe;再由①⑥可知化合物WZ、WZ2为FeS、FeS2,故W为Fe,Z为S。
本题难度:简单