| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《原电池原理》高频考点强化练习(2019年最新版)(八)
参考答案:D 本题解析:A.电子从a电极流出,则a电极是负极,因此a电极发生氧化反应,b电极发生还原反应,A错误;B.a电极通入的是CO,电极反应式为:CO+2OH-—2e-=CO2+H2O,B错误;C.A处通入的是CO,B处通入的是空气,C错误;D.用这种电池作电源精炼铜,若阴极质量增加6.4 g,即析出铜的质量是6.4g,物质的量是0.1mol,转移0.2mol电子,则根据方程式CO+2OH-—2e-=CO2+H2O可知至少消耗标准状况下的CO 2.24 L,D正确,答案选D。 本题难度:一般 3、简答题 铅蓄电池是最常见的二次电池,它是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质是硫酸.电池总反应式为:Pb+PbO2+4H++2SO42- (1)放电时:负极的电极反应式是______;电解液中H2SO4的浓度将变______;当外电路通过2mol电子时,理论上负极板的质量增加______g. (2)在完全放电耗尽PbO2和Pb时,若按如图连接,电解一段时间后,则在A电极上生成______、在B电极上生成______. 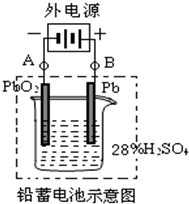 参考答案:(1)电池总反应式为:Pb+PbO2+4H++2SO42-放电 本题解析: 本题难度:一般 4、选择题 乙醇燃料电池中采用磺酸类质子溶剂,电池总反应为:C2H5OH+3O2=2CO2+3H2O下列说法错误的是( ) |
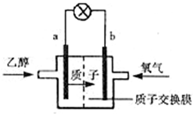
参考答案:A、该燃料电池放电时,带正电荷的微粒向正极移动,所以质子向正极移动,故A正确.
B、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,所以该燃料电池放电时,电流从正极b沿导线流向负极a,故B正确.
C、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,负极上燃料失去电子发生氧化反应,所以电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,故C错误.
D、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,正极上氧气得电子和氢离子反应生成水,所以电极反应式为4H++O2+4e-=2H2O,故D正确.
故选C.
本题解析:
本题难度:简单
5、填空题 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇: ?
反应I:?CO(g)?+?2H2(g)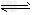 CH3OH(g)?ΔH1 ?
CH3OH(g)?ΔH1 ?
反应II:CO2(g)?+?3H2(g)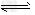 CH3OH(g)?+?H2O(g)?ΔH2
CH3OH(g)?+?H2O(g)?ΔH2
①在以上制备甲醇的两个反应中:反应I优于反应II,原因为___________。?
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。? 
I、在一密闭容器中发生反应Ⅰ并达到平衡后,保持其他条件不变,对容器升温,此反应的化学反应平衡应__________移动(填“正向”、“逆向”、“不”)?。
II、某温度下,将1mol?CO和4mol?H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=?0.1?mol/L,则CO的转化率为___________,此时的温度______________250℃(填“>”、“<”、“=”)
(2)已知在常温常压下:
①?2CH3OH(l)?+?3O2(g)?=?2CO2(g)?+?4H2O(g)?ΔH?=?-1275.6?kJ/mol
②?2CO?(g)+?O2(g)?=?2CO2(g)?ΔH?=?-566.0?kJ/mol
③?H2O(g)?=?H2O(l)?ΔH?=?-44.0?kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________________
(3)某同学依据甲醇燃烧的反应原理,设计如图所示的电池装置,工作一段时间后,测得溶液的pH将____________(填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:___________________。? 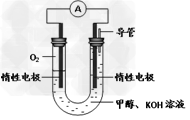
参考答案:(1)①反应I符合“原子经济性”的原则即原子利用率为100%
②I:逆向?; II:80%?;?<?
(2)CH3OH(l)+?O2(g)?=?CO(g)?+?2H2O(l)?ΔH=﹣442.8?kJ∕mol
(3)降低?; CH3OH-6e-+8OH-=CO32- +6H2O
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《中和滴定实.. | |