1、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1.0?L?0.1?mol?L-1?Na2CO3溶液中所含的CO离子数为0.1NA
B.质量均为7.8?g?Na2S、Na2O2的固体中含有的阴离子数均为0.1NA
C.标准状况下,22.4?L的CCl4分子中含有共价键数为4NA
D.电解饱和食盐水,当阴极产生2.24?L?H2时,转移的电子数一定为0.2NA
参考答案:B
本题解析:分析:A、碳酸钠溶液中碳酸根离子水解;
B、依据n= 计算物质的量,结合过氧化钠和硫化钠摩尔质量相同,过氧化钠由钠离子和过氧根离子构成分析;
计算物质的量,结合过氧化钠和硫化钠摩尔质量相同,过氧化钠由钠离子和过氧根离子构成分析;
C、CCl4分子在标准状况下不是气体;
D、不是标准状况,气体体积2.24 L H2不一定是0.1mol;
解答:A、碳酸根离子水解,1.0 L 0.1 mol?L-1 Na2CO3溶液中所含的CO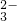 离子数小于0.1NA,故A错误;
离子数小于0.1NA,故A错误;
B、7.8 g Na2S、Na2O2的固体物质的量都是0.1mol,过氧化钠是钠离子和过氧根离子构成,所以含有的阴离子都为0.1mol,阴离子数均为0.1NA,故B正确;
C、CCl4分子在标准状况下不是气体,22.4 L的CCl4分子不是1mol,故C错误;
D、阴极产生2.24 L H2时,温度和压强不一定是标准状况,所以物质的量不一定是0.1mol,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要考查盐类水解,质量换算物质的量计算微粒数,气体摩尔体积的条件应用,题目难度中等.
本题难度:一般
2、选择题 含某物质的溶液,其体积为V?mL、密度为ρ?g?mL-1,物质的量浓度为c?mol?L-1,溶质的质量分数为W%,其中溶质为m?g,溶质的相对分子质量为M,则下列表示正确的是
A.c=
B.m=
C.W%=
D.c=
参考答案:BD
本题解析:分析:A.根据c= 判断,质量分数漏掉百分号;
判断,质量分数漏掉百分号;
B.根据m=ρV计算溶液的质量,再根据m(溶质)=m(溶液)×ω(溶质)计算判断;
C.根据c= 的公式变形进行计算判断;
的公式变形进行计算判断;
D.根据n= 计算溶质的物质的量,再根据c=
计算溶质的物质的量,再根据c=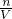 计算溶质的物质的量浓度,据此判断.
计算溶质的物质的量浓度,据此判断.
解答:含某物质的溶液,其体积为V?mL、密度为ρ?g?mL-1,物质的量浓度为c?mol?L-1,溶质的质量分数为W%,其中溶质为m?g,溶质的相对分子质量为M,则:
A.c= =
=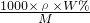 ,质量分数漏掉百分号,故A错误;
,质量分数漏掉百分号,故A错误;
B.溶液的质量为根据m(溶液)=ρV,故溶质质量m=ρV×W%=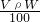 ,故B正确;
,故B正确;
C.根据c= 可知,W%=
可知,W%=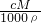 ,故C错误;
,故C错误;
D.溶质的物质的量为n= =
= mol,故溶液的物质的量浓度c=
mol,故溶液的物质的量浓度c=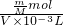 =
= mol/L,故D正确;
mol/L,故D正确;
故选BD.
点评:本题考查物质的量浓度有关计算、物质的量浓度与质量分数的关系等,难度中等,注意对公式的理解与灵活运用.
本题难度:一般
3、选择题 0.5L?1mol/L?FeCl3溶液中的Cl-的物质的量浓度数值为
A.3
B.1.5
C.1
D.0.5
参考答案:A
本题解析:分析:根据溶液的浓度和化合物的构成计算溶质离子浓度.
解答:FeCl3在溶液中完全电离,由FeCl3可知,氯离子浓度是FeCl3浓度3倍.
所以0.5L?1mol/L?FeCl3溶液中c(Cl-)=3c(FeCl3)=3×1mol/L=3mol/L.
故选A.
点评:本题考查溶液物质的量浓度的计算,题目难度不大,注意基础知识的掌握.
本题难度:简单
4、选择题 某NaOH溶液的溶质质量分数是10%,则此溶液中Na+与H2O的个数比为
A.1:10
B.1:20
C.1:11.5
D.1:23
参考答案:B
本题解析:分析:令溶液的质量为100g,则氢氧化钠的质量为10g,水的质量为100g-10g=90g,根据n= 计算氢氧化钠、水的物质的量,钠离子的物质的量等于氢氧化钠的物质的量,物质的量之比等于分子数之比,据此计算判断.
计算氢氧化钠、水的物质的量,钠离子的物质的量等于氢氧化钠的物质的量,物质的量之比等于分子数之比,据此计算判断.
解答:令溶液的质量为100g,则氢氧化钠的质量为10g,水的质量为100g-10g=90g.
10g氢氧化钠的物质的量为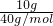 =0.25mol,所以钠离子的物质的量为0.25mol.
=0.25mol,所以钠离子的物质的量为0.25mol.
90g水的物质的量为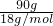 =5mol.
=5mol.
所以此溶液中Na+与H2O的个数比为0.25mol:5mol=1:20.
故选:B.
点评:考查常用化学计量的有关计算、质量分数,难度不大,关键清楚溶液的组成,注意基础知识的掌握.
本题难度:困难
5、选择题 下列叙述正确的是
A.1molCO2的质量为44g?mol-1
B.固体或液体物质的体积主要决定于微粒个数及微粒之间的平均距离
C.SO42-的摩尔质量为96g
D.O2的摩尔质量为32g?mol-1
参考答案:D
本题解析:分析:A、质量的单位是g.
B、固体和液体物质的体积主要决定于微粒个数和粒子的大小.
C、摩尔质量的单位是g/mol.
D、氧气分子的摩尔质量在数值等于其相对分子质量.
解答:A、1mol二氧化碳的质量为44g,故A错误.
B、固体和液体中粒子之间的距离是非常小的,所以固体和液体物质的体积主要决定于微粒个数和粒子的大小,故B错误.
C、SO42-的摩尔质量为96g/mol,故C错误.
D、氧气分子的摩尔质量在数值等于其相对分子质量,即为32g?mol-1,故D正确.
故选D.
点评:本题考查了基本概念和基本理论,难度不大,注意基础知识的积累.
本题难度:困难