1、选择题 把4.6g钠投入到95.6g水中,不考虑水的蒸发,所得溶液中溶质的质量分数是
A.4.6%
B.7.7%
C.8.0%
D.10%
参考答案:C
本题解析:试题分析:4.6g钠的物质的量是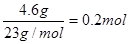 ,根据方程式2Na+2H2O=2NaOH+H2↑可知,生成的氢氧化钠是0.2mol,氢气是0.1mol。所以根据质量守恒定律可知反应后溶液的质量是4.6g+95.6g-0.1mol×2g/mol=100g,因此所得溶液中溶质的质量分数是
,根据方程式2Na+2H2O=2NaOH+H2↑可知,生成的氢氧化钠是0.2mol,氢气是0.1mol。所以根据质量守恒定律可知反应后溶液的质量是4.6g+95.6g-0.1mol×2g/mol=100g,因此所得溶液中溶质的质量分数是 ,答案选C。
,答案选C。
考点:考查溶液质量分数的有关计算
点评:该题属于基础性试题,难度不大。解题的关键是准确溶液中的溶质以及溶液的质量。
本题难度:一般
2、选择题 在一密闭容器中,盛放A、B、C三种物质各30g,经电火花引燃,充分反应后,各物质质量变化如下:
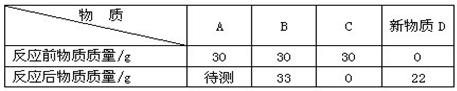
关于此反应,下列认识不正确的是
A.C物质中所含有的元素种类是A、B、D三种物质中所有元素种类之和
B.变化后待测的A质量为5g
C.变化后生成B物质3g
D.C物质一定是化合物
参考答案:B
本题解析:分析:生成物的质量增加,反应物的质量减少,由表中各物质的质量变化可知C为反应物,B、D为生成物.
参加反应的C的质量为30g,生成的D的质量为22g,生成的B的质量为33g-30g=3g.
根据质量守恒定律可知,A为生成物,生成的A的质量为30g-22g-3g=5g.
所以反应为分解反应,该反应可表示为C→A+B+D.
解答:由物质的质量变化可知C为反应物,B、D为生成物,参加反应的C的质量为30g,生成的D的质量为22g,生成的B的质量为33g-30g=3g.根据质量守恒定律可知,A为生成物,生成的A的质量为30g-22g-3g=5g.所以反应为分解反应,该反应可表示为C→A+B+D.
A、该反应为分解反应,根据化学变化前后元素的种类不变,可判断分解反应的反应物C中所含元素应是生成物A、B、D三种物质中所有元素种类之和,故A正确;
B、A为生成物,生成的A的质量为30g-22g-3g=5g,所以变化后待测的A质量为30g+5g=35g,故B错误;
C、由表中数据可知,生成的B的质量为33g-30g=3g,故C正确;
D、物质C由A、B、D三种物质化合生成,则C物质一定是化合物,故D正确.
故选:B.
点评:考查质量守恒定律,难度不大,根据物质的质量变化判断反应物与生成物,根据质量守恒判断A是生成物是解题的关键.
本题难度:一般
3、选择题 下列物质在光照时不反应的是 ?
A.氢气和氯气的混合气体
B.次氯酸
C.氢气和氧气的混合气体
D.氯水
参考答案:C
本题解析:试题分析:氢气和氯气的混合气体在光照的条件下,能迅速化合生成氯化氢;次氯酸见光易分解生成氯化氢和氧气;氢气和氧气在光照的条件下不能化合,二者只有在点燃的条件下,才能化合生成水;氯水中含有次氯酸,光照时次氯酸易分解,答案选C。
考点:考查化学反应中条件的选择
点评:本题属于基础性试题,难度不大。解题的关键是学生要熟练记住常见化学反应的条件以及常见物质的化学性质。
本题难度:困难
4、选择题 设NA为阿伏加德罗常数的值.下列说法正确的是
A.常温常压下,将0.1mol?Fe投入足量的浓硝酸中,转移的电子为0.3NA
B.1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
C.电解精炼铜时,阴极质量增加3.2g时,转移电子0.2NA
D.25℃时,pH=11的Na2CO3的水溶液中水所电离出来的H+数为10-3NA
参考答案:B
本题解析:分析:A、常温下铁在浓硝酸中 发生钝化现象;
B、过氧化钠由钠离子和过氧根离子构成,氧化钠由钠离子和氧离子构成;
C、电解精炼阴极上析出铜,结合电极反应计算电子转移;
D、依据碳酸钠溶液中存在离子积常数结合盐类水解和水的电离平衡分析计算.
解答:A、常温下铁在浓硝酸中 发生钝化现象,铁表面形成致密氧化物薄膜,阻止反应进行,故A错误;
B、过氧化钠由钠离子和过氧根离子构成,氧化钠由钠离子和氧离子构成,1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA,故B正确;
C、电解精炼铜时,阴极质量增加3.2g为铜,物质的量为0.05mol,依据电极反应Cu2++2e-=Cu,转移电子0.1NA,故C错误;
D、25℃时,pH=11的Na2CO3的水溶液中,碳酸根离子水解,氢氧根离子是水全部电离出的离子,依据离子积常数可知,c(H+)(剩余)?c(OH-)(水)=10-14;溶液中水所电离出来的H+数为10-11NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要考查物质构成,电解精炼原理的应用,盐类水解后溶液中离子积的计算应用,注意铁在常温下在浓硝酸中 发生钝化,题目难度中等.
本题难度:困难
5、选择题 下列叙述正确的是
A.1molCO2的质量为44g?mol-1
B.固体或液体物质的体积主要决定于微粒个数及微粒之间的平均距离
C.SO42-的摩尔质量为96g
D.O2的摩尔质量为32g?mol-1
参考答案:D
本题解析:分析:A、质量的单位是g.
B、固体和液体物质的体积主要决定于微粒个数和粒子的大小.
C、摩尔质量的单位是g/mol.
D、氧气分子的摩尔质量在数值等于其相对分子质量.
解答:A、1mol二氧化碳的质量为44g,故A错误.
B、固体和液体中粒子之间的距离是非常小的,所以固体和液体物质的体积主要决定于微粒个数和粒子的大小,故B错误.
C、SO42-的摩尔质量为96g/mol,故C错误.
D、氧气分子的摩尔质量在数值等于其相对分子质量,即为32g?mol-1,故D正确.
故选D.
点评:本题考查了基本概念和基本理论,难度不大,注意基础知识的积累.
本题难度:困难