1、选择题 用8 mol·L-1的磷酸溶液和氨气配制一种培养液,要使此溶液中NH4H2PO4和(NH4)2HPO4的物质的量之比为3∶1,每升溶液中含磷元素0.1 mol,现要配制4 L这种溶液,需标况下的氨气的体积为 ( )。
A.2.8 L
B.5.6 L
C.11.2 L
D.22.4 L
参考答案:C
本题解析:据题意知,最终得到0.3 mol NH4H2PO4和0.1 mol(NH4)2HPO4,据氮元素守恒知:n(NH3)=n(NH4+)=0.3 mol+0.2 mol=0.5 mol,标况下NH3体积为11.2 L。
本题难度:一般
2、简答题 实验室要配制0.1mol/L的Na2CO3(aq)500mL.
(1)需要称取Na2CO3粉末的质量为______.
(2)配制上述溶液除需要托盘天平(带砝码)、药匙、玻璃棒、烧杯外,还需要的仪器有______、______.
(3)配制过程中,若未洗涤烧杯和玻璃棒,则所配制溶液的浓度将______(填“偏高”、“偏低”或“不影响”).
参考答案:(1)500mL 0.1mol/L的Na2CO3溶液中含有碳酸钠的物质的量为:0.1mol/L×0.5L=0.05mol,需要碳酸钠的质量为:106g/mol×0.05mol=5.3g,
故答案为:5.3g;
(2)配制500mL 0.1mol/L的Na2CO3溶液使用的仪器为:托盘天平(带砝码)、药匙、玻璃棒、烧杯、胶头滴管、500mL容量瓶,所以还缺少胶头滴管、500mL容量瓶,
故答案为:胶头滴管;500mL容量瓶;
(3)配制过程中,若未洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小,根据c=nV可得,配制的溶液浓度偏低,
故答案为:偏低.
本题解析:
本题难度:简单
3、计算题 (10分)将固体草酸锰MnC2O4·2H2O放在一个可以称出质量的容器中加热。固体质量随温度的变化关系如图所示。
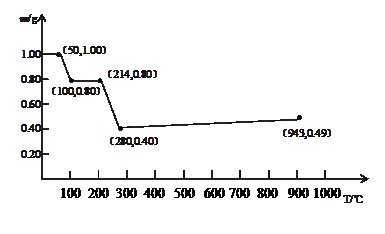
(1)214℃,剩余固体的成分为?(填写化学式,下同);280℃时,剩余固体的成分为?。
(2)当温度超过280℃时,剩余固体的质量又会增加,943℃完全生成另一种固体物质,则280℃-943℃过程中发生反应的化学方程式为?。
(3)草酸锰受热可生成MnO2,MnO2是一种重要的无机功能材料,在硫酸锰溶液中加入NaClO可生成MnO2和Cl2,请写出向硫酸锰溶液中加入NaClO时发生反应的化学方程式?。
参考答案:(1)MnC2O4; MnO--------6分(3分+3分)
(2)2MnO + O2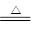 2MnO2------2分
2MnO2------2分
(3)MnSO4 + 2NaClO = MnO2 + Cl2 ↑+ Na2SO4-------2分
本题解析:(1)1gMnC2O4·2H2O中结晶水的质量是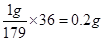 。根据图像可知,214℃固体质量减少2hi0.2g,所以此时固体是MnC2O4;设此时固体的摩尔质量是x,则
。根据图像可知,214℃固体质量减少2hi0.2g,所以此时固体是MnC2O4;设此时固体的摩尔质量是x,则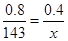 ,解得x=71,所以是MnO。
,解得x=71,所以是MnO。
(2)空气中含有氧气,所以在加热的条件下,能把MnO氧化。设此时固体的摩尔质量是y,则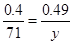 ,解得y=87,所以应该是二氧化锰,方程式为2MnO + O2
,解得y=87,所以应该是二氧化锰,方程式为2MnO + O2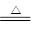 2MnO2。
2MnO2。
(3)次氯酸钠的还原产物是氯气,1mol氧化剂得到1mol电子,而1mol还原剂失去2mol电子,所以方程式为MnSO4 + 2NaClO = MnO2 + Cl2 ↑+ Na2SO4。
本题难度:一般
4、选择题 下列说法正确的是
[? ]
A.二氧化碳的相对分子质量是44?
B.“物质的量浓度”可简称为“量浓度”
C.阿伏加德罗常数的单位是mol-1?
D.1?mol任何物质所占体积都是22.4?L
参考答案:AC
本题解析:
本题难度:简单
5、选择题 下列物质分别与73g10%盐酸恰好完全反应,所得溶液中溶质的物质的量浓度最小的是( )
A.Mg(OH)2
B.MgO
C.Mg
D.MgCO3
参考答案:73g10%盐酸含有氯化氢的物质的量为73g×10%36.5g/mol=0.2mol.
A、发生反应Mg(OH)2+2HCl=MgCl2+H2O,根据反应可知0.2molHCl反应,需0.1molMg(OH)2,溶液增重为Mg(OH)2的质量为0.1mol×58g/mol=5.8g;
B、发生反应MgO+2HCl=MgCl2+H2O,根据反应可知0.2molHCl反应,需0.1molMgO,溶液增重为MgO的质量为0.1mol×40g/mol=4g;
C、发生反应Mg+2HCl=MgCl2+H2↑,根据反应可知0.2molHCl反应,需0.1molMg,生成氢气0.1mol,溶液增重为Mg的质量减去生成的氢气的质量为0.1mol×24g/mol-0.1mol×2g/mol=2.2g;
D、发生反应MgCO3+2HCl=MgCl2+H2O+CO2↑,根据反应可知0.2molHCl反应,需0.1molMgMgCO3,生成CO20.1mol,溶液增重为MgCO3的质量减去生成的CO2的质量为0.1mol×84g/mol-0.1mol×44g/mol=4g;
所以溶液质量增重为Mg(OH)2>MgO=MgCO3>Mg.
溶液中氯化镁的物质的量相同,所以溶液质量越大,氯化镁浓度越小,所以与Mg(OH)2反应,所得溶液浓度最小.
故选A.
本题解析:
本题难度:一般