| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《物质的量》答题技巧(2019年最新版)(四)
参考答案:D 本题解析:A选项不知道溶液的体积,故醋酸分子的数目不能确定,A错误;B没说标况,气体的物质的量不能求算,分子数不能确定,B错误;5.6 g即0.1mol铁粉完全反应需要氯气0.15mol,氯气不足应按氯气计算转移电子数为0.2 NA,C错误;过氧化氢的电子式为: 本题难度:困难 2、选择题 下列溶液中物质的量浓度为1mol/L的是 ( ) |
参考答案:D
本题解析:A、应该配成1L的溶液;
B、不是标况下,22.4L不一定为1mol;
C、最后溶液体积,不一定为10L
本题难度:一般
3、选择题 同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3,②NO2,进行喷泉实验,经充分反应后,瓶内溶液的物质的量浓度为
A.①=②
B.①>②
C.①<②
D.不能确定
参考答案:A
本题解析:在相同条件下,气体摩尔体积相同,烧瓶的容积相同,根据n=知,氨气、NO2的物质的量之比为1:1,因NO2能与水反应:3NO2+2H2O=2HNO3+NO,所以各烧瓶中溶质的物质的量之比为3:2,做喷泉实验时,盛放氨气的烧瓶、含NO2的烧瓶,各烧瓶中溶液的体积分别为:一烧瓶、烧瓶,所以溶液的体积比为3:2,因此各物质的量浓度之比为=1:1,答案选A。
本题难度:一般
4、选择题 设 为阿伏伽德罗常数的值。下列说正确的是
为阿伏伽德罗常数的值。下列说正确的是
A.高温下,0.2molFe与足量稀硫酸反应反应,生成的H2分子数目为0.3
B.2 L0.5 mol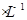 硫酸钾溶液中阴离子所带电荷数为
硫酸钾溶液中阴离子所带电荷数为
C.C2H4和N2组成的42g混合气体中原子的个数为3
D. 反应中,生成28gN2时,转移的电子数目为3.75
反应中,生成28gN2时,转移的电子数目为3.75
参考答案:D
本题解析:A.铁与稀硫酸反应Fe+2H+=Fe2++H2↑,0.2molFe与足量稀硫酸反应反应,生成的H2分子数目为0.2 ,A错误;B.2 L0.5 mol
,A错误;B.2 L0.5 mol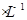 硫酸钾溶液中阴离子所带电荷数为2
硫酸钾溶液中阴离子所带电荷数为2 ,B错误;C.C2H4和N2的分子量都是28,物质的量为1.5mol,乙烯为6原子分子,氮气为2原子分子,无法确定混合气体中的原子个数,C错误;D.该化学反应电子转移为15mol,生成氮气4mol(112g),则生成28gN2时,转移的电子数目为3.75
,B错误;C.C2H4和N2的分子量都是28,物质的量为1.5mol,乙烯为6原子分子,氮气为2原子分子,无法确定混合气体中的原子个数,C错误;D.该化学反应电子转移为15mol,生成氮气4mol(112g),则生成28gN2时,转移的电子数目为3.75 ,D正确;选D。
,D正确;选D。
考点:考查阿伏伽德罗常数的计算。
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数的值。下列叙述正确的是?(?)
A.常温常压下,1molC2H4所含的电子数为12 NA
B.标准状况下,16g甲烷中共价键数目为4NA
C.常温常压,4 g氦气所含的核外电子数为4NA
D.标准状况下,22.4L NO 与11.2L O2充分反应后,所得的气体分子数一定为NA
参考答案:B
本题解析:A中,常温常压下,1molC2H4所含的电子数为16NA,故A错误;B中,标准状况下,16g甲烷为1mol,故其共价键数目为4NA,B正确;C中,常温常压下,4 g氦气不为2mol,故C错误;D中,22.4L NO 与11.2L O2充分反应生成1molNO2,NO2会生成NO4,故所得所得的气体分子数一定小于NA,故D错误,答案为B。
点评:本题考查阿伏伽德罗常数的应用,是高考考查的重点,本题容易误选D,学生在做题的时候要理解,生成的NO2会生成NO4,故不能选,本题有一定的综合性。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《原电池原理.. | |