1、选择题 下列溶液中有关微粒的物质的量浓度关系正确的是?(?)

参考答案:C
本题解析:A、电荷守恒来看,RO32-要乘以2;
B、碳酸铵水解相互促进,硫酸铵正常水解,硫酸铁铵相互抑制,故铵根浓度③>②>①;
C、电荷守恒;
D、根据质子守恒列式,错误。HS-,本身就有。
本题难度:一般
2、填空题 (10分)某温度下0.1 mol·L-1Na2CO3溶液中,c(Na+)/c(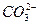 )=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(
)=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(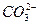 )=5/2>20/9,其原因是_________,此时c(
)=5/2>20/9,其原因是_________,此时c(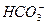 )=_________。
)=_________。
参考答案: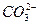 +H2O
+H2O
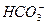 +OH-?
+OH-?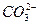 +CO2+H2O====
+CO2+H2O====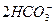 ? 0.04 mol·L-1
? 0.04 mol·L-1
本题解析: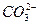 发生水解:
发生水解: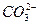 +H2O
+H2O
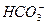 +OH-,导致c(
+OH-,导致c(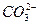 )减少。通入CO2后,发生
)减少。通入CO2后,发生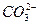 +CO2+H2O====
+CO2+H2O====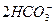 ,导致c(
,导致c(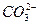 )较大程度地减少。因c(Na+)="0.2" mol·L-1,由c(Na+)/c(
)较大程度地减少。因c(Na+)="0.2" mol·L-1,由c(Na+)/c(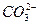 )=5/2得溶液中c(
)=5/2得溶液中c(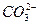 )="0.08" mol·L-1,说明反应消耗的c(
)="0.08" mol·L-1,说明反应消耗的c(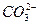 )="0.02" mol·L-1,由
)="0.02" mol·L-1,由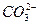 +CO2+H2O====
+CO2+H2O====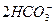 得c(
得c(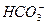 )=0.04 mol·L-1。
)=0.04 mol·L-1。
本题难度:简单
3、选择题 关于氯化铁水解的说法错误的是
[? ]
A.水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动
B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
C.有50℃和20℃的同浓度的FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
D.为抑制Fe3+水解,较好地保存FeCl3溶液,应加少量盐酸
参考答案:C
本题解析:
本题难度:一般
4、选择题 某碱性溶液中只含有Na+、CH3COO-、H+、OH- 4种离子。下列描述正确的是
A.该溶液一定是由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
B.该溶液一定由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成
C.该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.加入一定量冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+)
参考答案:D
本题解析:等物质的量的NaOH与CH3COOH混合,生成CH3COONa水解显碱性,但NaOH过量也可。A错误;两者混合时,CH3COOH过量,溶液显酸性,B错误;当NaOH的物质的量远大于CH3COOH时,溶液中离子浓度可能为c(Na+)>
c(OH-)>c(CH3COO-)>c(H+),C错误;电荷守恒方程式为c(CH3COO-)+
c(OH-)=c(Na+)+c(H+),原溶液中c(OH-)>c(H+),则c(CH3COO-)<c(Na+),加入冰醋酸,c(CH3COO-)不断增大,则会存在c(CH3COO-)等于或大于c(Na+)的情况,D正确。
本题难度:一般
5、选择题 下列说法正确的是
A.常温下pH=12的NaOH溶液,与等体积0.01mol·L一l氯化铵溶液混合后所得溶液中:c(Na+)=c(NH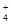 )
)
B.新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.室温下,向0.0lmol/L? NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO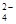 )>c(NH
)>c(NH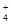 )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
D.物质的量浓度均为0.lmol/L的NaA和NaB棍合溶液中,粒子浓度的关系一定为:c(Na+)>c(OH-)>c(HA)>c(HB)
参考答案:C
本题解析:A、等浓度的NaOH和NH4Cl反应,得到的NH4+会发生水解,不相等,错误;B、根据浓度大小:c(H+)>c(Cl-)> >c(OH-)>c(ClO-),错误;C、NH4HSO4和NaOH按1:1混合时,溶液呈酸性,因此NaOH需要过量,正确;D、不能确定A、B离子的强弱,因此无法判断,错误。
本题难度:一般