1、选择题 对于0.1mol?L-1?NH4Cl溶液,正确的是( )
A.升高温度,溶液pH升高
B.通入少量HCl,c(NH4+)和c(Cl-)均增大
C.c(NH4+)+c(OH-)=c(Cl-)+c(H+)
D.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
2、填空题 (12分)在常温下,下列五种溶液:
①0.1mol/L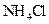 ? ②0.1mol/L
? ②0.1mol/L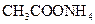 ? ③0.1mol/L
? ③0.1mol/L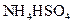
④0.1mol/L 和0.1mol/L
和0.1mol/L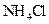 混合液? ⑤0.1mol/L
混合液? ⑤0.1mol/L
请根据要求填写下列空白:
(1)溶液①呈?性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
(2)在上述五种溶液中,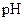 最小的是?;
最小的是?;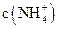 最小的是?(填序号)
最小的是?(填序号)
(3)比较溶液②、③中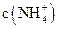 的大小关系是②?③(填“>”、“<”或“=”)
的大小关系是②?③(填“>”、“<”或“=”)
(4)在溶液④中,?离子的浓度为0.1mol/L; 和?离子的物质的量浓度之和为0.2mol/L。
和?离子的物质的量浓度之和为0.2mol/L。
(5)常温下,测得溶液②的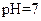 ,则说明
,则说明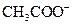 的水解程度?(填“>”、“<”或“=”)
的水解程度?(填“>”、“<”或“=”)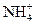 的水解程度,
的水解程度,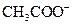 与
与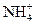 浓度的大小关系是:
浓度的大小关系是:
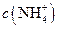 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
3、选择题 25°C时,在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的是:
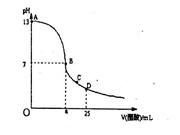
A.在A、B间任一点,溶液中一定都有c(Na+)﹥c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c,( CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+ )
4、选择题 在一定条件下,Na2CO3溶液中存在平衡CO32-+H2O HCO3-+OH-。下列说法错误的是
HCO3-+OH-。下列说法错误的是
A.稀释溶液, 增大
增大
B.通入CO2,溶液pH减小
C.升高温度,c(CO32-)减小
D.加入NaOH固体, 减小
减小
5、选择题 下列有关盐类水解的说法不正确的是()
A.盐类的水解过程破坏了纯水的电离平衡
B.盐类的水解是酸碱中和反应的逆反应
C.盐类水解的结果使盐溶液不一定显中性
D.Na2CO3溶液中c(Na+)是c( )的2倍
)的2倍