|
高考化学知识点总结《能量的相互转化》试题预测(2019年最新版)(二)
2020-08-13 05:21:38
【 大 中 小】
|
1、选择题 在相同条件下,下列物质分别与H2反应,当消耗等物质的量H2时放出热量最多的是
[? ]
A.Cl2
B.Br2
C.I2
D.S
参考答案:A
本题解析:
本题难度:简单
2、填空题 (12分)下列三个反应在某密闭容器中进行:
反应①? Fe(s)+CO2(g) FeO(s)+CO(g)?△H1=" a" kJ·mol-1 FeO(s)+CO(g)?△H1=" a" kJ·mol-1
反应②? 2CO(g)+O2(g) 2CO2(g)?△H2=" b" kJ·mol-1 2CO2(g)?△H2=" b" kJ·mol-1
反应③? 2Fe(s)+O2(g) 2FeO(s)?△H3 2FeO(s)?△H3
(1)则△H3=?(用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为?
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a?0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有?(填序号)。
A.缩小反应器体积
B.再通入CO2
C.升高温度
D.使用合适的催化剂
| (4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为: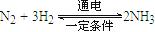 。则在电解法合成氨的过程中,应将H2不断地通入?极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为?。 。则在电解法合成氨的过程中,应将H2不断地通入?极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为?。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”), 可推断a ?0.01(填大于、等于或小于)。
参考答案:(1)(2a+b)kJ·mol-1
(2)50% ?;(3)>(1);BC(4)阳? N2+6H++6e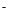 =2NH3)?(5)中,大于。 =2NH3)?(5)中,大于。
本题解析:盖斯定律的应用。反应热也遵守盖斯定律,可以看到
反应③=2①+ ② 所以(1)则△H3=(2a+b)kJ·mol-1
Fe(s)+CO2(g) FeO(s)+CO(g) FeO(s)+CO(g)
起始物质的量浓度? 1? 1? 0? 0
变化物质的量浓度? x? x? x? x
平衡物质的量浓度? 1-x? 1-x? x? x
已知500℃时反应①的平衡常数K=1.0=x/(1-x)?所以x=0.5?达到平衡时CO2的转化率为100%x/(1-x)=50%
将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,平衡向正反应方向移动,说明该反应是吸热反应,则a>0?;为了加快化学反应速率且使体系中CO的物质的量增加,平衡必需向正向移动,而反应前后气体体积不变化,所以可以采取的措施有?
再通入CO2 ;升高温度 ,使用催化剂,只能改变化学反应速率,但是平衡不会移动。
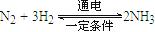 ?从化合价的变化上可以看到氢气的化合价升高,做还原剂,所以在电解法合成氨的过程中,应将H2不断地通入阳极;在另一电极通入N2,该电极反应式为 ?从化合价的变化上可以看到氢气的化合价升高,做还原剂,所以在电解法合成氨的过程中,应将H2不断地通入阳极;在另一电极通入N2,该电极反应式为
N2+6H++6e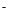 =2NH3?在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),根据质子守恒,知道氢离子和氢氧根的浓度也相等,所以溶液显中性, 可推断a 大于0.01,如实等体积等浓度混合,溶液也会显示酸性,所以显示中性,a 必须大于0.01 =2NH3?在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),根据质子守恒,知道氢离子和氢氧根的浓度也相等,所以溶液显中性, 可推断a 大于0.01,如实等体积等浓度混合,溶液也会显示酸性,所以显示中性,a 必须大于0.01
点评:此题综合性很强,考查知识点广。盖斯定律的内容为:在定压定容条件下,任意一个反应其总反应的热效应只与反应的始态和终态有关而与反应的路程无关。只要学生学习过程中牢记并理解这些基本定义,便不难解答此题。
本题难度:一般
3、填空题 二氧化碳是一种宝贵的碳氧资源。以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s)?△H1="a" kJ·mol-1 NH2CO2NH4(s)?△H1="a" kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g)?△H2=+72.49kJ·mol-1 CO(NH2)2(s)+H2O(g)?△H2=+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)?△H3=-86.98kJ·mol-1 CO(NH2)2(s)+H2O(g)?△H3=-86.98kJ·mol-1
请回答下列问题:
(1)反应Ⅰ的△H1=__________kJ·mol-1(用具体数据表示)。
(2)反应Ⅱ的△S______(填>或<)0,一般在__________情况下有利于该反应的进行。
(3)反应Ⅲ中影响CO2平衡转化率的因素很多,下图1为某特定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2平衡转化率变化的趋势曲线。
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是________(填提高或降低)水碳比。
②当温度高于190℃后,CO2平衡转化率出现如图1所示的变化趋势,其原因是__________。
 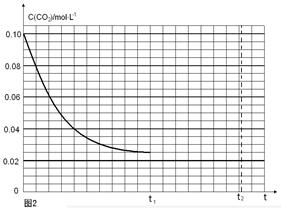
(4)反应Ⅰ的平衡常数表达式K1=____________________;如果起始温度相同,反应Ⅰ由在恒温容器进行改为在绝热(与外界没有热量交换)容器中进行,平衡常数K1将__________(填增大、减少、不变)。
(5)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如上图2所示。若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
(6)尿素在土壤中会发生反应CO(NH2)2+2H2O (NH4)2CO3。下列物质中与尿素有类似性质的是______。 (NH4)2CO3。下列物质中与尿素有类似性质的是______。
A.NH2COONH4
B.H2NOCCH2CH2CONH2
C.HOCH2CH2OH
D.HOCH2CH2NH2
参考答案:(14分)(1)-159.47(2分)?(2)>(1分)?高温(1分)
(3)①降低(1分)②温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低,(2分,给出合理解释即可给分)。
(4)K?1=1/[c2(NH3)·c(CO2)] (2分),减少(1分)
(5)
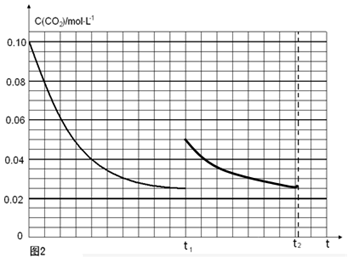 (注意:曲线的起点、平衡点和变化趋势共2分) (注意:曲线的起点、平衡点和变化趋势共2分)
(6)A、B(2分)
本题解析:解:(1)反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s)△H1="a" kJ·mol-1 NH2CO2NH4(s)△H1="a" kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g)△H2=+72.49kJ·mol-1 CO(NH2)2(s)+H2O(g)△H2=+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1 CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1
由盖斯定律总反应Ⅲ-反应Ⅱ,得到2NH3(g)+CO2(g) NH2CO2NH4(s)△H1=a=-159.47kJ·mol-1, NH2CO2NH4(s)△H1=a=-159.47kJ·mol-1,
故答案为:-159.47;
(2)反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g)△H2=+72.49kJ?mol-1,反应前后气体体积增大,△S>0,焓变分析可知是吸热反应,△H>0,所以依据反应自发进行的判断依据△H-T△S<0,需要在高温下反应自发进行,故答案为:>;高温; CO(NH2)2(s)+H2O(g)△H2=+72.49kJ?mol-1,反应前后气体体积增大,△S>0,焓变分析可知是吸热反应,△H>0,所以依据反应自发进行的判断依据△H-T△S<0,需要在高温下反应自发进行,故答案为:>;高温;
(3)①反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是降低水碳比,二氧化碳转化率增大,故答案为:降低; CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是降低水碳比,二氧化碳转化率增大,故答案为:降低;
②反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)△H3=-86.98kJ?mol-1,是放热反应,升温高于190℃,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行, CO(NH2)2(s)+H2O(g)△H3=-86.98kJ?mol-1,是放热反应,升温高于190℃,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行,
故答案为:温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低;
(4)反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s)△H1=-159.47kJ?mol-1,平衡常数K= NH2CO2NH4(s)△H1=-159.47kJ?mol-1,平衡常数K=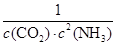 ?; ?;
起始温度相同,反应Ⅰ由在恒温容器进行改为在绝热(与外界没有热量交换)容器中进行,反应是放热反应,随反应进行温度升高平衡逆向进行,平衡常数减小;
(5)在恒温下将0.4mol NH3和0.2mol CO2放入容积为2L的密闭容器中,达到平衡时,
2NH3(g)+CO2(g) NH2CO2NH4(s) NH2CO2NH4(s)
起始量(mol·L-1)? 0.2? 0.1? 0
变化量(mol·L-1) 0.15? 0.075
平衡量(mol·L-1) 0.05? 0.025
t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如图2所示.若其他条件不变,t1时将容器体积压缩到1L,二氧化碳浓度应增大到0.05mol·L-1,压强增大,平衡正向进行,由于生成物是固体,所以达到平衡状态,二氧化碳浓度保持不变,据此画出变化曲线为:
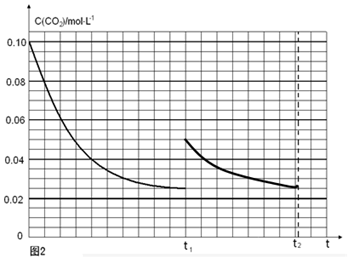 ; ;
(6)尿素在土壤中会发生反应CO(NH2)2+2H2O (NH4)2CO3.分析结构特征可知,物质性质取决于官能团,尿素中氨基和羰基相连和水反应生成铵根离子,所以选项中符合此结果特征的有类似性质: (NH4)2CO3.分析结构特征可知,物质性质取决于官能团,尿素中氨基和羰基相连和水反应生成铵根离子,所以选项中符合此结果特征的有类似性质:
A.NH2COONH4,结构中含有与羰基连接的氨基,故A符合;
B.H2NOCCH2CH2CONH2结构中含有与羰基连接的氨基,故B符合;
C.HOCH2CH2OH,结构中不含有氨基,故C不符合;?
D.HOCH2CH2NH2,分子中的氨基不是和羰基连接,不具备次性质,故D不符合;
故答案为:A、B。
本题难度:一般
4、选择题 下列方程式的书写或描述正确的是
A.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-
B.热化学方程式C2H2(g)+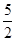 O2(g) O2(g)
C.铂电极电解MgCl2饱和溶液:MgCl2
D.H+(aq)+OH(aq)
参考答案:A
本题解析:
正确答案:A
A、沉淀的转化,溶解度大的CaSO4转化为难溶的CaCO3;
B、不正确,水不是液态;
C、不正确,2H2O+MgCl2
D、不正确,应为稀H2SO4,浓硫酸稀释时放热。
本题难度:一般
5、选择题 在生产和生活中,人们广泛利用着化学反应释放的能量。下列说法正确的是( )
A.物质发生化学变化并不一定都伴随着能量变化
B.用实验方法和理论方法研究反应热的化学称为热化学
C.有能量变化的都是化学变化
D.任何反应中的能量变化都表现为热量变化
参考答案:B
本题解析:物质发生化学变化时一定伴随着能量变化,A错;灯泡发光的过程中有能量
变化,但该过程不是化学变化,C错;化学反应中的能量变化大部分表现为热量变
化,但也有其他能量变化,如热能、光能,D错。
本题难度:一般
| 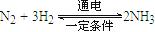 。则在电解法合成氨的过程中,应将H2不断地通入?极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为?。
。则在电解法合成氨的过程中,应将H2不断地通入?极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为?。