1、填空题 0.1molNH4+中约含有 个N,约含有 个H.
参考答案:6.02 × 1022; 2.408 × 1023
本题解析:根据化学式可知,离子中含有1该氮原子。用于 ,所以0.1molNH4+中约含有6.02 × 1022个氮原子;而氢原子是0.1mol×4×6.02 × 1023/mol=2.408 × 1023
,所以0.1molNH4+中约含有6.02 × 1022个氮原子;而氢原子是0.1mol×4×6.02 × 1023/mol=2.408 × 1023
本题难度:一般
2、填空题 在标准状况下,空气中N2和O2的体积比约为4∶1,则N2和O2的物质的量之比为_________,空气的密度约为_________,空气的平均相对分子质量为_________。
参考答案:4∶1? 1.29 g·L-1? 29
本题解析:同温、同压下,两种气体的体积之比等于它们的分子数或物质的量之比,所以N2和O2的物质的量之比为4∶1。设n(N2)="4" mol,n(O2)="1" mol,则V="(1+4)mol×22.4" L·mol-1="112" L。
所以空气的密度:
ρ=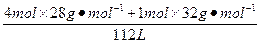 ≈1.29 g·L-1
≈1.29 g·L-1
其平均摩尔质量
 ≈29 g·mol-1
≈29 g·mol-1
本题难度:简单
3、选择题 同温同压下,相同质量的下列气体体积最大的是( )
A.甲烷
B.氯气
C.二氧化碳
D.氧气
参考答案:A
本题解析:
本题难度:一般
4、选择题 若用NA表示阿伏加德罗常数的值,下列叙述不正确的是
A.1 mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA
B.锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4 L,锌失去电子数为2NA
C.常温常压下,20 g D2O含有的原子总数为3NA
D.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA
参考答案:A
本题解析:A、BrCl中Br与Cl元素的化合价分别是+1价和-1价,与H2O完全反应生成氯化氢和次溴酸,元素的化合价均没有变化,不是氧化还原反应,A不正确;B、锌与硫酸反应不论是生成二氧化硫还是氢气,每产生1mol气体,均转移2mol电子,混合气是22.4L÷22.4L/mol=1mol,因此锌失去电子数为2NA,B正确;C、常温常压下,20 g D2O的物质的量是20g÷(1×2+18)g/mol=1mol,含有的原子总数为3NA,C正确;D、.标准状况下,44.8 L NO与22.4 L O2混合后恰好生成2molNO2,但NO2存在平衡:2NO2 N2O4,因此气体中分子总数小于2NA,D正确,答案选A。
N2O4,因此气体中分子总数小于2NA,D正确,答案选A。
本题难度:一般
5、选择题 将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是 ( )。
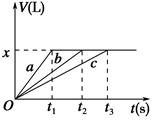
A.x=2.24
B.钠的物质的量为0.2 mol
C.反应时,Na、Mg、Al均过量
D.曲线b为Mg与盐酸反应的图像
参考答案:C
本题解析:由图像可以看出,生成气体的体积相等,则盐酸完全反应,x=2.24,A正确。根据生成的H2为2.24 L,可知Na失去0.2 mol电子,则钠的物质的量为0.2 mol,B正确。反应时如果钠过量,则钠会与水反应,生成的气体多于2.24 L,故C错误。根据反应速率可知a、b、c依次是Na、Mg、Al与盐酸反应的图像,D正确。
本题难度:一般