1、选择题 下列关于平衡移动的说法不正确的是(? )
A.当v(正)=v(逆)时,平衡不移动
B.当v(正)>v(逆)时,平衡向正反应方向移动
C.当v(正)<v(逆)时,平衡向正反应方向移动
D.反应速率发生改变,平衡不一定发生移动
参考答案:C
本题解析:当v(正)>v(逆)时,单位时间内反应物消耗的多、生成的少,生成物生成的多、消耗的少,反应正向移动。同理,当v(正)=v(逆)时,平衡不移动;当v(正)<v(逆)时,平衡逆向移动。当v(正)、v(逆)扩大或缩小相同倍数后,正、逆反应速率相等,平衡不移动。
本题难度:简单
2、选择题 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇,
(催化剂为Cu2O/ZnO):CO(g)+2H2(g)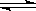 CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是?(?)?
CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是?(?)?

A.反应达到平衡时,平衡常数表达式 K=c(CH3OH)/c(CO)·c2(H2)
B.升高温度,K值增大
C.在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=3tB /2nB mol·(L·min)-1
D.其他条件不变,E点的体积压缩到原来的1/2,重新平衡时n(H2)/n(CH3OH)增大
参考答案:A
本题解析:略
本题难度:简单
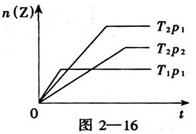
3、选择题 反应2X(g)+Y(g)  ?2Z(g)△H﹤0,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如图2—16所示。则下述判断正确的是(?)
?2Z(g)△H﹤0,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如图2—16所示。则下述判断正确的是(?)
A.T1<T2,p1<p2
B.T1<T2,p1>p2
C.T1>T2,p1>p2
D.T1>T2,p1<p2
参考答案:C
本题解析:根据图像可知,当压强相等时,温度为T1的曲线首先到达平衡状态,这说明T1>T2;同样分析可知,当温度相等时,压强为P1的曲线首先到达平衡状态,这说明p1>p2,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重考查学生的能力。在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。
本题难度:一般
4、选择题 一定条件下,在反应2SO2 (g) +O2(g)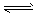 2SO3(g)平衡体系中: n (SO2) =2.0 mol/L , n(O2) = 0.8 mol/L, n (SO3)=2.4 mol/L ,则 SO2 的起始浓度的范围为
2SO3(g)平衡体系中: n (SO2) =2.0 mol/L , n(O2) = 0.8 mol/L, n (SO3)=2.4 mol/L ,则 SO2 的起始浓度的范围为
[? ]
A . 0.4~2.0 mol/L
B . 0.4~4.4 mol/L
C . 0~4 mol/L
D . 无法确定
参考答案:B
本题解析:
本题难度:一般
5、计算题 一定条件下,可逆反应:A2+B2 2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。
2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。
请回答:
(1)a、b应满足的关系是 ?(2)a的取值范围是 ?
参考答案:(1)a-b=0.4?
(2)0.4≤a≤1.3
本题解析:(1)根据化学方程式得A2、B2的物质的量浓度的变化量相等,所以有0.5-a=0.1-b或a-0.5=b-0.1,化简得a-b=0.4;
(2)若反应正向进行,C的起始浓度最小是0,则A转化的最大浓度是1.6mol/L/2=0.8mol/L,所以a最大是0.5+0.8=1.3;b应是≥0,所以由a-b=0.4得a≥0.4,综合起来0.4≤a≤1.3。
本题难度:一般