1、选择题 将4molA和2molB放入2L密闭容器中发生反应
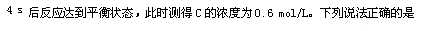
A.4 s内,υ(B)=0.075 mol/(L ·s)
B.当c(A)︰c(B)︰c(C)=2︰1︰2时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
参考答案:A
本题解析:A:υ(C)=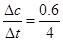 =0.15 mol/(L ·s),依据系数比可推出υ(B)=0.075 mol/(L ·s),正确
=0.15 mol/(L ·s),依据系数比可推出υ(B)=0.075 mol/(L ·s),正确
B:c(A)︰c(B)︰c(C)=2︰1︰2只是一个特定状态,与是否平衡没有直接关系,排除
C:升温,平衡左移,则C的物质的量浓度减小,排除
D:缩小容器体积,相当于加压,平衡正向移动,A的转化率增大,排除
答案为A
本题难度:一般
2、选择题 某温度下,在容积固定不变的密闭容器中进行如下可逆反应:X(g)+Y(g) (g)+W(s) ΔH>0一段时间后,达到化学平衡状态.下列叙述正确的是
(g)+W(s) ΔH>0一段时间后,达到化学平衡状态.下列叙述正确的是
A.通入稀有气体,平衡向正反应方向移动
B.加入少量W,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.降低温度,平衡向逆反应方向移动
参考答案:D
本题解析:A中方程式中各种物质的浓度是不变的,所以平衡不移动。B中W是固体,不影响平衡的移动和反应速率。C中升高温度,正逆反应速率都是增大的。正反应是吸热反应,所以降低温度平衡向逆反应方向移动,D正确,答案选D。
本题难度:一般
3、填空题 (共11分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法l:还原沉淀法
该法的工艺流程为:
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显?色。
(2)能说明第①步反应达平衡状态的是??。
A.Cr2O2- 7和CrO2- 7的浓度相同? B.2v(Cr2O2- 7)=v(CrO2- 4)? C.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s) Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至?。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为??。
(5)在阴极附近溶液pH升高的原因是(用电极反应式解释) ?。溶液中同时生成的沉淀还有?。
参考答案:(共11分)(1)橙 (1分);(2)C(2分);?(3)5(2分);
(4)阳极反应为Fe-2e-=Fe2+(2分);提供还原剂Fe2+(1分)
(5)2H+ +2e-=H2↑(2分);Fe(OH)3 (1分)
本题解析:(1)pH=2说明溶液显酸性,平衡向正反应方向移动,Cr2O72—的浓度会增大,所以溶液显橙色。
(2)在一定条件下的可逆反应里,当正反应速率和逆反应速率相等,反应物的浓度与生成物的浓度不再改变时,该可逆反应就到达化学平衡状态。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此选项A不正确;在任何情况下Cr2O72—和CrO42—的反应速率之比总是满足1:2,因此选项B也不正确;颜色的深浅与浓度有关系,溶液颜色不再改变,这说明Cr2O72—和CrO42—的浓度不再发生改变,因此可以说明反应已经达到化学平衡状态,C正确,答案选C。
(3)由溶度积常数的表达式Ksp=c(Cr3+)·c3(OH—)=10-32可知,当c(Cr3+)=10-5mol/L时,c(OH—)=10-9mol/L,所以pH=5。
(4)Cr2O72—要生成Cr(OH)3沉淀,必需有还原剂,而铁做电极时,在阳极上可以失去电子产生Fe2+,阳极方程式为Fe-2e-=Fe2+。
(5)在电解池中阳离子在阴极得到电子,在溶液中由于H+得电子得能力强于Fe2+的,因此阴极是H+放电,方程式为2H++2e-=H2↑。随着电解的进行,溶液中的H+浓度逐渐降低,水的电离被促进,OH-浓度逐渐升高。由于Fe2+被Cr2O72—氧化生成Fe3+,当溶液碱性达到一定程度时就会产生Fe(OH)3沉淀。
本题难度:一般
4、选择题 在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol/L。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是(?)
A.在2 s时,体系内压强为反应前的1.1倍
B.前2 s,以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
C.平衡时,体系内含N2O4 0.25 mol
D.平衡时,若往容器内充入氮气,则可提高N2O4的转化率
参考答案:A
本题解析:反应进行到2 s时,NO2的浓度为0.02 mol/L,则生成NO2是0.1mol,因此消耗N2O4是0.05mol,所以在2 s时,体系内压强为反应前的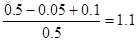 ,A正确。前2 s,以N2O4浓度变化表示的平均反应速率为
,A正确。前2 s,以N2O4浓度变化表示的平均反应速率为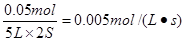 ,B不正确。平衡时容器内压强为反应前的1.6倍,则平衡时气体的物质的量是0.5mol×1.6=0.8mol。根据反应式N2O4
,B不正确。平衡时容器内压强为反应前的1.6倍,则平衡时气体的物质的量是0.5mol×1.6=0.8mol。根据反应式N2O4 2NO2可知,消耗N2O4是0.3mol,剩余是0.2mol,C不正确。冲入氮气,压强增大,但浓度不变,所以平衡不移动,D不正确。答案选A。
2NO2可知,消耗N2O4是0.3mol,剩余是0.2mol,C不正确。冲入氮气,压强增大,但浓度不变,所以平衡不移动,D不正确。答案选A。
本题难度:一般
5、选择题 反应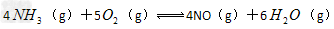 在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.3mol,则此反应的平均速率可表示为
在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.3mol,则此反应的平均速率可表示为
[? ]
A.v?(NH3)=0.001mol·L-1·s-1?
B.?v?(H2O)=0.01?mol·L-1·s-1
C.v?(NO)=0.09?mol·L-1·min-1?
D.v?(O2)=0.05mol·L-1·min-1
参考答案:D
本题解析:
本题难度:简单