1、选择题 对于反应A2 + 3B2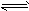 2C来说,以下化学反应速率的表示中,反应速率最快的是
2C来说,以下化学反应速率的表示中,反应速率最快的是
[? ]
A.v(B2) =0.8mol/(L·s)
B.v(A2) =0.4mol/(L·s)
C.v(C) =0.6mol/(L·s)
D.v(B2) =4.2mol/(L·min)
参考答案:B
本题解析:
本题难度:简单
2、选择题 2SO2(g)+O2(g)  2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
?
| 甲
| 乙
| 丙
| 丁
|
起始物质的量
| n(SO2)/mol
| 0.40
| 0. 40
| 0.80
| 0
|
n(O2)/mol
| 0.24
| 0.48
| 0.48
| 0.04
|
n(SO3)/mol
| 0
| 0
| 0
| 0.40
|
含硫反应物的平衡转化率/%
| 80
| α1
| α2
| α3
|
?
下列判断中,正确的是(?)
A.丁中SO3的平衡转化率为α3=80%
B.该温度下,平衡常数的值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率小于乙中O2的转化率
参考答案:B
本题解析:2SO2(g) + O2(g)  ?2SO3(g)
?2SO3(g)
起始/mol 0.40?0.24? 0
转化/mol? 2x?x? 2x
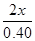 ×100%=80%,x=0.16
×100%=80%,x=0.16
K= =400,B正确;C项,丙相当于把甲的体积缩小一半,平衡右移,所以丙中c(SO3)比甲中的2倍多,错误;D项,乙中增大O2的浓度,其自身转化率减小,错误;A项,丁和甲是等效平衡,甲平衡时SO3为0.32 mol,所以丁中SO3分解了0.40 mol-0.32 mol=0.08 mol,其转化率为
=400,B正确;C项,丙相当于把甲的体积缩小一半,平衡右移,所以丙中c(SO3)比甲中的2倍多,错误;D项,乙中增大O2的浓度,其自身转化率减小,错误;A项,丁和甲是等效平衡,甲平衡时SO3为0.32 mol,所以丁中SO3分解了0.40 mol-0.32 mol=0.08 mol,其转化率为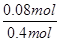 ×100%=20%,错误。
×100%=20%,错误。
本题难度:一般
3、选择题 反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,达到平衡,下列条件能使平衡移动的是(?)
CO(g)+H2(g)在一可变容积的密闭容器中进行,达到平衡,下列条件能使平衡移动的是(?)
A.增加C的量
B.加催化剂
C.保持体积不变,充入氮气使体系压强增大
D.保持压强不变,充入氮气使容器体积增大
参考答案:D
本题解析:A、因浓度越大,化学反应速率越快,但是固体量的增减不影响反应速率,所以增加C(s)的量,反应速率不变,化学平衡不移动,故错;
B、催化剂能改变化学反应速率,不能使化学平衡移动,故错;
C、保持体积不变,充入氮气,氮气不参与反应,反应体系中的各物质的浓度不变,则反应速率不变,化学平衡不移动,故错;
D、保持压强不变,充入氮气,使容器的体积变大,反应体系中各物质的浓度减小,则反应速率减小,化学平衡发生移动,故对。
故选D。
点评:影响化学平衡移动的因素有:温度、浓度、压强,需要注意的是改变纯固体或液体的量、使用催化剂,化学平衡不移动,压强改变必须引起浓度的改变才能引起化学化学平衡的移动。
本题难度:简单
4、选择题 如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) + 3B(g)  2C(g)? ΔH="-192" kJ·mol-1。向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
2C(g)? ΔH="-192" kJ·mol-1。向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
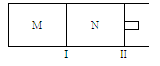
A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y
B.若x∶y=1∶2,则平衡时,M中的转化率:A>B
C.若x∶y=1∶3,当M中放出热量172.8 kJ时,A的转化率为90%
D.若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.36 mol A时,v(正)<v(逆)
参考答案:AD
本题解析:M容器保持恒容,N容器保持恒压,
由于反应前后的气体系数和不等,所以两个平衡态也不一样。要让M、N中平衡时A的体积分数一样,那么只能是M或N中,反应前后不论限度多少,A的体积分数始终为定值。
A(g) + 3B(g)  2C(g)
2C(g)
起始:? x? y
反应:? z? 3z? 2z
平衡:? x-z? y-3z? 2z
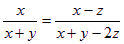 ,则x=y,故A正确;
,则x=y,故A正确;
x∶y=1∶2,即y=2 x,设反应中消耗掉amol A
A(g) + 3B(g)  2C(g)
2C(g)
n(初始)?x? 2x? 0
△n? a? 3a? 2a
n(平衡) x-a? 2x-3a? 2a
A的转化率=a/x,B的转化率=3a/2x,则平衡时,M中的转化率:A<B,故B错误;
C、题目中热化学方程式的意义:若1mol A完全反应,放热192 kJ,
选项中:x∶y=1∶3,设反应中消耗掉bmol A
即y=3x,A(g) + 3B(g)  2C(g)?放热
2C(g)?放热
n(初始)?x? 3x? 0? 192x kJ
△n? b? 3b? 2b? 172.8 kJ
即?xmol:192x kJ= b:172.8 kJ,则b="0.9" mol
故A的转化率= b/ x=0.9/ x,C错误;
D、? A(g) + 3B(g)  2C(g)
2C(g)
n(初始)? 1.2? 1? 0
△n? 0.2? 0.6? 0.4
n(平衡)? 1? 0.4? 0.4
则平衡常数K=(0.2 mol/L)2/[0.5 mol/L×(0.2 mol/L)3]=10
原平衡体系中,2.0L容器中含有分子1.0+0.4+0.4=1.8mol,当加入A,体系瞬间有分子1.8+0.36=2.16mol。N容器恒温、恒压,则容器体积比=气体的物质的量比,
即:2.16/1.8=V/2,瞬间总体积(V)变为2.16×2.00/1.8=2.4L,所以:
Q=(0.4 mol/2.4L)2/[(1.36 mol/2.4L) ×(0.4 mol/2.4L)3]=10.6
Q>K,所以,平衡要逆向移动,即v(正)<v(逆),故D正确;
本题难度:一般
5、选择题 一定条件下的某可逆反应,其正反应速率υ(正)和逆反应速率υ(逆)随时间的变化如图所示,下列判断正确的是
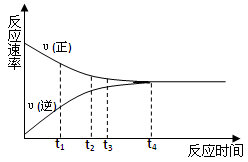
A.t1时刻,υ(正)< υ(逆)
B.t2时刻,υ(正)> υ(逆)
C.t3时刻,υ(正)= υ(逆)
D.t4时刻,υ(正)= υ(逆)
参考答案:BD
本题解析:由图像可知t4时刻之前,正反应速率总是大于逆反应速率.t4是正逆反应速率相等,反应达到化学平衡状态,所以正确的答案是BD.
本题难度:一般