1、选择题 实验室需配制一种强酸溶液500mL,c(H+)=2mol/L,下列配制方法可行的是
A.取100mL5mol/ LH2SO4,加入400mL水
LH2SO4,加入400mL水
B.取200mL5mol/LHCl,加水稀释至500mL
C.取100 mL 5mol/LH2SO4,加500mL水稀释
5mol/LH2SO4,加500mL水稀释
D.取100 mL5mol/LHNO3,加水稀释至500mL
2、填空题 (7分)已知“84消毒液”的有效成分是NaClO。试根据所学知识完成下列问题。
(1)试以食盐、水为原料,设计实验室制取“84消毒液”。(已知电解食盐水可得到氯气、氢氧化钠、水)
①实验内容为:电解食盐水制得氯气;
②实验内容为:?;
反应方程式为:?
③将制得的溶液装瓶保存。
(2)“84消毒液”的消毒原理是(用化学方程式表示)?。用于杀死病菌的成分是?(写化学式)。
3、填空题 (7分)有一无色混合气体可能是由HCl、NO、NO2、CO2、NH3、H2中的一种或几种混合而成,将此气体通过盛有浓H2SO4时的洗气瓶时,气体体积减小。继续通过装有过氧化钠的干燥管,发现从出气口出来的气体显红棕色,再将该气体全部通入盛满水倒立于水槽中的试管内,发现最后试管里仍为一满试管液体.由此可推知原气体中一定存在__________? ____,一定不存在__________? _ ____,由最终结果可知原气体中________? _ 气体的体积比为?
4、实验题 某学生利用以下装置探究喷泉实验。其中A、F分别为硫化氢和氯气的发生装置,C为纯净干燥的氯气与硫化氢反应的装置。
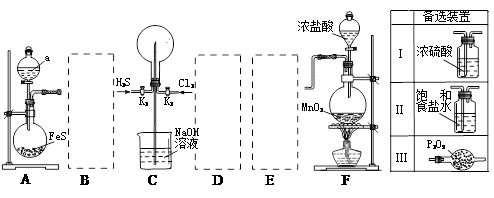
请回答下列问题:
(1)装置F中发生反应的化学方程式?。
(2)装置A中的分液漏斗内液体a可选用?(选填以下选项的代号)
A.盐酸? B.浓硫酸? C.稀硫酸? D.稀硝酸
(3)虚线框内应添加必要的除杂装置,请从上图的“备选装置”中选择合适装置的编号,填入下列空格。B__________、D__________、E__________。
(4)打开K1、K2,将常温压下的H2S、Cl2以体积比1:1充满烧瓶后,烧瓶中发生的反应用化学方程式表示为?;关闭K1、K2,始终看不到烧瓶内产生“喷泉”现象,理由是:?。
(5)在操作(4)的基础上,引发喷泉操作方法是?。
5、填空题 已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是?。
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量??(填“相等、不相等”),所求中和热?(填“相等、不相等”),
(3)已知滇池中学高二一班某同学的实验记录如下,
实验次数
| 酸的温度
| 碱的温度
| 反应最高温度
|
1
| 21.5℃
| 20.5℃
| 24.3℃
|
2
| 21.5℃
| 21.5℃
| 25.0℃
|
3
| 16.0℃
| 18.5℃
| 21.5℃
|
请根据有用数据计算中和热(酸碱的密度均视为1g/ml, C=4.17J/g.℃)?
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会?;(填“偏大”、“偏小”、“无影响”)。