1、选择题 下图是实验室制备CO2的简易装置图。用该装置制备CO2可起到随时使反应发生或停止的效果。选项中装置可起到与右图装置相同效果的是( )

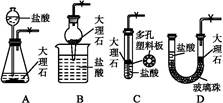
参考答案:B
本题解析:A装置如果关闭活塞,继续反应产生的CO2可以把液体压入长颈漏斗,但锥形瓶中剩余的液体继续与大理石反应,错误;B装置中的干燥管可以随时提起,正确;C装置为密闭体系、不能排开液体,错误;D装置,如果关闭活塞,继续反应产生的CO2,无法将右侧液体压下,因为左侧与大气不通,错误
本题难度:一般
2、选择题 实验室制取下列气体时,与实验室取氨气的气体发生装置相同的是
A.CO2
B.H2
C.Cl2
D.O2
参考答案:D
本题解析:实验室制取氨气的反应是NH4Cl与Ca(OH)2反应,固体与固体反应,而实验室制取CO2、H2、Cl2都是固液反应,故不合题意。而制取氨气是用高锰酸钾加热反应,为固体与固体反应,其发生装置一样,故 D项符合题意。
点评:本题可以从装置出发,但是更简便的可以从氨气的制气反应的原理判断属于哪一类反应类型,符合哪一类实验装置,再进行选择。
本题难度:一般
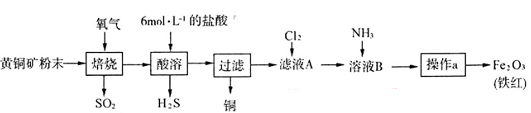
3、实验题 (19分)黄铜矿的主要成分是CuFeS2(硫元素显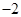 价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
已知:
 ?
? =
=
(1)在实验室中,应将黄铜矿粉末放在__________(填仪器名称)中焙烧。
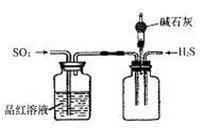
(2)将反应过程中产生的SO2和H2S通入下图所示装置中检验它们的性质。该实验证明SO2具有_________性和__________性。
(3)欲选用下列部分装置在实验室中以MnO2和浓盐酸为原料制取纯净、干燥的氯气。
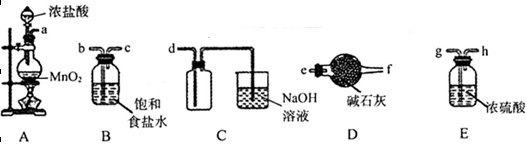
①圆底烧瓶中发生反应的离子方程式为_________________________________________。
②按气流方向由左到右,导管口连接顺序为a→__________________________________。
③装置连接好后,在装药品前,需检验装置的气密性,具体方法是__________________。
④向滤液A中通入C12,某同学取通入C12后的溶液滴加KSCN溶液,用来证明C12的氧化性比Fe3+强的结论。该实验设计是否合理________(填“是”或“否”),请用简要文字解释你的理由_____________________________________________________________。
(4)若使用20 g黄铜矿粉末可制得8 gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是________ (假设各步反应均完全进行且过程中无额外物质损耗)。
参考答案:(19分)
(1)坩埚(2分)
(2)漂白(2分);氧化(2分)
(3)①MnO2+4H++2Cl? Mn2++Cl2↑2H2O(3分)②b→c→g→h→d(2分)
Mn2++Cl2↑2H2O(3分)②b→c→g→h→d(2分)
③关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气。(3分)
④否(1分),在通氯气前滤液A中就可能含有Fe3+,无法确定Fe3+一定是Fe2+被Cl2氧化得来的。(2分)
(4)92%(2分)
本题解析:(1)固体的焙烧在坩埚内进行。
(2)SO2通入品红溶液,证明SO2具有漂白性;SO2通入H2S溶液,生成S淡黄色沉淀,证明SO2具有氧化性。
(3)①MnO2与浓盐酸反应生成Cl2、MnCl2、H2O。离子方程式为:MnO2+4H++2Cl? Mn2++Cl2↑2H2O
Mn2++Cl2↑2H2O
②生成的Cl2含有HCl、H2O,所以a连接b、c,通过饱和食盐水除去HCl、继续连接g、h,通过浓硫酸,除去H2O,再连接d,即可收集纯净、干燥的氯气。
③利用加热气体膨胀的原理进行装置气密性的检验,所以检验方法为:关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气。
④因为该检验方法是先通入氯气,再滴加KSCN溶液,在通氯气前滤液A中就可能含有Fe3+,无法确定Fe3+一定是Fe2+被Cl2氧化得来的,所以该实验设计不合理。
(4)根据Fe元素守恒可得:2CuFeS2~ Fe2O3,所以该黄铜矿中含CuFeS2的质量分数=8g×368/160÷20g×100%=92%
本题难度:一般
4、选择题 利用下列各组中的物质制备并收集少量相应的气体,能采用如图装置的是
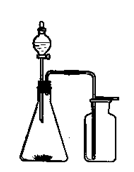
①浓氨水和固体NaOH制NH3?②大理石和稀盐酸制CO2
③过氧化氢溶液和二氧化锰制O2④稀硝酸和铜片制NO
⑤浓盐酸和二氧化锰制Cl2?⑥电石和水制C2H2
⑦锌粒和稀硫酸制H2?⑧乙醇和浓硫酸制C2H4A.②③? B.①⑥⑦?C.②⑤⑧?D.①④⑥
参考答案:A
本题解析:题目所给实验装置适用于固体和液体不用加热的反应,制备的气体密度大于空气,可用向上排空气法收集,符合的气体有:CO2、O2,故A项正确。
本题难度:一般
5、实验题 (15分)某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。
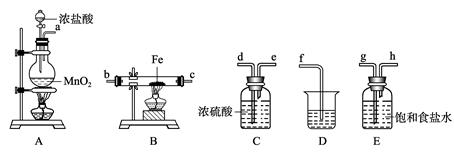
请回答下列问题:
(1) A中发生反应的化学方程式为______ _________________________________。
_________________________________。
(2)各装置的正确连接顺序为(填写装置代号)A→______→______→______→
______D。
(3)装置C的作用是________________________________________________,
写出装置D中反应的离子方程式___________ _________________________。
_________________________。
(4)反应开始后,B中硬质玻璃管内的现象为______________________________ ;
;
可以检验生成物中含有Fe3+的试剂是____________(填写试剂名称)。
(5) 该小组欲用下图所示装置收集尾气,并测量多余气体的体积。

①若如 图所示量气装置由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是________(填“酸式”或“碱式”)滴定管。
图所示量气装置由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是________(填“酸式”或“碱式”)滴定管。
②为提高测量的准确性,上图装置中的液体可用________,
收集完气体后,读数前应进行的操作是____________。
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面, 会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
参考答案:(15分)(1) 4HCl(浓)+MnO2 ?MnCl2+Cl2↑+2H2O(2分)
?MnCl2+Cl2↑+2H2O(2分)
(2) E→C→B(2分)
(3)干燥Cl2,防止FeCl3的水解(1分);Cl2+2OH– = Cl– + ClO–+H2O(2分)
(4)棕(红)色的烟(1分);硫氰酸 钾(1分)
钾(1分)
(5)①碱式(1分)
②饱和NaCl溶液(1分);上下移动滴定管,使左右两边液面相平(2分)
③偏大(2分)
本题解析:略
本题难度:一般