1、实验题 某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
(1)m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下碳与浓硫酸不反应;②_____________。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式____________。
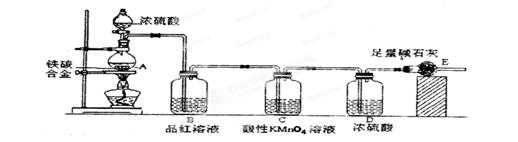
(3)B中的现象是:____________;C的作用是:_______________。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。则铁碳合金中铁的质量分数为_____________。
2、实验题 用2.4 mol/L的H2SO4溶液配制100mL浓度为0.2 mol/L的稀H2SO4,回答下列问题:
(1)需用量筒量取2.4 mol/L的H2SO4溶液的体积是?mL。
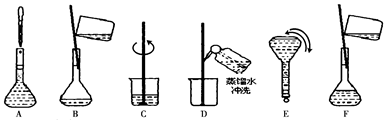
(2)溶液配制的所需的基本步骤如下:
将上述实验步骤A到F按实验过程先后次序排列___________________?。
(3)上述实验步骤A、B、E、F都用到的仪器名称为__________。?
(4)取上述所配溶液10mL与足量BaCl2溶液反应,生成白色沉淀0.48 g。则该溶液
浓度?0.2 mol/L(填“大于”“等于”或“小于”),造成此误差的操作可能
是?。?
a. 定容时俯视容量瓶;? b. 用量筒取2.4 mol/LH2SO4溶液时俯视读数;
c. 容量瓶使用前未干燥;d. 使用的烧杯和玻璃棒未洗涤彻底;
e. 定容时将蒸馏水洒在容量瓶外面
3、选择题 下列各组气体通常情况下能大量共存,并且既能用浓硫酸干燥,又能用碱石灰干燥的是
[? ]
A. SO2、O2、HBr
B. NH3、O2、N2
C. NH3、CO2、HCl
D. H2、CH4、O2
4、填空题 (11分)下图物质A~K均由a、b、c、d、e、f五种元素组成。a、b、c、d、e、f为原子序数依次增大的短周期元素;由a、b、c、d四种元素形成酸式盐A;b的最外层电子数是电子层数的2倍;由d、e元素可形成两种离子化合物,且阳离子与阴离子的个数比都为2 : 1,其中一种为X;B、C、D为常见的气体;F为白色胶状物质。(部分产物未列出)
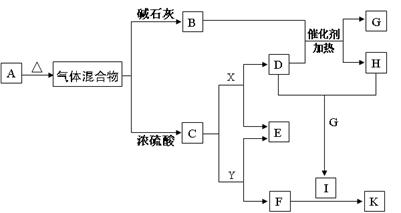
(1)物质A的化学式_______________
(2)Y的溶液呈?性(填“酸性” 、“碱性” 或“中性”),用离子反应方程式解释原因:?
(3)将溶液K蒸干灼烧,得到的固体产物为?,此固体产物的用途是?(答出一条即可)
(4)B与H在一定条件下反应生成c单质和G,反应中氧化产物与还原产物物质的量之比为?
(5)常温下,向0.1mol/L的K溶液中加入Na2O2,加入Na2O2的质量与产生沉淀的质量具有如图所示关系
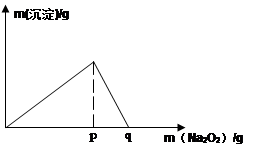
①当溶液pH=?,开始生成沉淀(已知生成沉淀的Ksp=1×10-31 )
②p点时产生沉淀与放出气体的物质的量之比为??
③从开始加Na2O2固体至q点的整个过程中,总反应的离子方程式为??。
5、选择题 某学生配制一定物质的量浓度的氢氧化钠溶液后,经测定发现溶液浓度偏低。该学生找出以下原因,其中不会使溶液浓度偏低的是(?)
A.没有用蒸馏水洗烧杯2—3次,并将洗液移入容量瓶中
B.容量瓶刚用蒸馏水洗净,没有烘干
C.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
D.定容时仰视刻度线