1、简答题 (1)根据下列七种物质,回答问题:
A、干冰;B、氧化镁;C、氯化铵;D、固态碘;E、烧碱;F、冰;G、过氧化钠;
①含非极性键的是______;②只含有极性键的是______;
③既有离子键又有共价键的是______;④只含有离子键的是______;
(2)温度、固体表面积、气体压强、溶液的浓度、催化剂等都能改变化学反应速率,下列各项分别与哪个影响化学反应速率因素的关系最为密切.
①同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完.______
②镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生.______
③两支装有相同H2O2的试管,向其中一支加入MnO2,有大量气泡冒出.______.
参考答案:(1)①固态碘中碘碘键为非极性键,过氧化钠中存在氧氧非极性键,故答案为:DG;
②干冰和水中只含极性键,故答案为:A、F;
③氯化铵中铵根内存在氮氢共价键,铵根和氯离子间存在离子键;NaOH中钠离子和氢氧根离子间存在离子键,氧原子和氢原子间存在共价键;过氧化钠中钠离子和过氧根离子间存在离子键,氧原子和氧原子间存在共价键,故答案为:C、E、G;
④氧化镁只含离子键,故答案为:B;
(2)①增大反应物接触面积,可以加快化学反应速率,所以同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完,故答案为:固体表面积;
②升高温度,加快化学反应速率,所以镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生,故答案为:温度;
③因使用催化剂,可以加快化学反应速率,所以MnO2加入双氧水中反应更剧烈,故答案为:催化剂.
本题解析:
本题难度:一般
2、计算题 物质结构理论有助于人们理解物质变化的本质,进行分子设计和研究反应规律。请回答下列问题:
(1)第三周期基态原子有2个未成对电子且电负性最大的元素是_____;
(2)金属晶体受到外力作用时易发生形变,而离子晶体容易破裂。试从结构的角度分析其中的主要原因____________;
(3)已知在水中存在平衡2H2O=H3O++OH-。下列分子中,中心原子采取的杂化方式与H3O+中氧原子的杂化方式相同的是_____
a.CH2=CH2中的碳原子? b.NH2-中的氮原子
c.ClO3-中的氯原子? d.NO2-中的氮原子
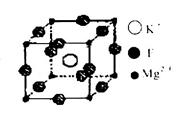
(4)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中Mg元素的质量分数为________。
参考答案:(1)S(或硫磺)(1分) (2)金属晶体是由金属阳离子和“自由电子”通过金属键形成的层状紧密堆积结构(1分),当金属受外力作用时,金属晶体中各原子层会发生相对滑动,产生形变,自由电子使得各层之间始终保持着金属键的作用(1分)。离子晶体中由于阴阳离子间存在着静电作用,使阴阳离子不能发生自由移动,因而受到外力作用时离子键被破坏而使晶体破裂(1分)
(3)bc(2分) (4)20%(2分)
本题解析:(1)第三周期基态原子中含有两个未成对电子的元素有Si、S两种元素,同一周期中,元素的电负性随着原子序数的增大而增大,所以Si的电负性小于S元素。
(2)金属晶体的构成微粒是金属阳离子和自由电子,存在的作用力是金属键,金属晶体是由金属阳离子和自由电子通过金属键形成的层状紧密堆积结构。当金属受外力作用时,金属晶体中各原子层会发生相对滑动,产生形变,自由电子使得各层之间始终保持着金属键的作用;离子晶体中存在的微粒是阴阳离子,存在的作用力是离子键,离子晶体中由于阴阳离子间存在着静电作用,使阴阳离子不能发生自由移动,因而受到外力作用时离子键被破坏而使晶体破裂。
(3)H3O+中中心氧原子含有3个σ键和一个孤电子对,所以其价层电子对数是4,则氧原子采取sp3杂化。a.CH2═CH2中的每个碳原子含有3个σ键且不含孤电子对,所以采取sp2杂化,故错误;b.NH2-中的氮原子含有2个σ键和(5+1-2×1)÷2=2个孤电子对,所以氮原子采取sp3杂化,故b正确;c.ClO3-中的氯原子含有3个σ键和(7+1-3×2)÷2=1个孤电子对,所以其价层电子对数是4,则氯原子采取sp3杂化,故c正确;d.NO2-中的氮原子含有2个σ键和(5+1-2×2)÷2=1个孤电子对,所以其价层电子对数是3,所以氮原子采取sp2杂化,故d错误,因此答案选bc。
(4)根据晶胞结构并依据均摊法可知,该晶胞中含有镁原子个数=8×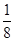 =1,钾原子个数=1,氟原子个数=12×
=1,钾原子个数=1,氟原子个数=12×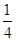 =3,所以其化学式为KMgF3,因此该化合物中镁元素的质量分数=
=3,所以其化学式为KMgF3,因此该化合物中镁元素的质量分数=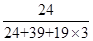 ×100%=20%。
×100%=20%。
本题难度:一般
3、选择题 下列物质中,既有离子键,又有共价键的是
[? ]
A.MgCl2
B.KOH
C.NH3
D.H2O2
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列表述正确的是( )
A.醛基的结构简式
B.聚丙烯的结构简式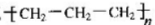
C.四氯化碳分子的电子式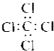
D.丙烷分子的球棍模型
参考答案:A.醛基的结构简式为-CHO,故A错误;
B.聚丙烯的结构简式为: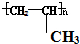 ,故B错误;
,故B错误;
C.四氯化碳的电子式为: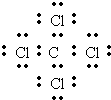 ,故C错误;
,故C错误;
D.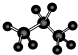 原子之间为单键,主链有3个碳原子,氢原子数为8个,符合丙烷的结构,故D正确;
原子之间为单键,主链有3个碳原子,氢原子数为8个,符合丙烷的结构,故D正确;
故选D.
本题解析:
本题难度:简单
5、填空题 (8分,每空2分)自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
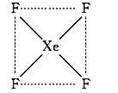
(1)请根据XeF4的结构示意图判断这个分子是极性分子还是非极性分子?_________?。
(2)XeF2晶体是一种无色晶体,下图为它的晶胞结构图。XeF2晶体属于哪种类型的晶体?_________;其堆积方式属于__________(填“钾型”“镁型”或“铜型”)。
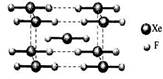
(3)一个XeF2晶胞中实际拥有XeF2__________个。
参考答案:(1)非极性分子 (2)分子晶体 钾型 (3)2
本题解析:(1)根据XeF4的结构示意图可判断,分子是平面正方形结构,所以是非极性分子。
(2)由于是由分子构成的,所以是分子晶体。根据晶胞结构可知,其堆积方式属于钾型。
(3)根据晶胞结构可知,一个XeF2晶胞中实际拥有XeF2是8×1/8+1=2。
本题难度:一般