1、填空题 (12分)已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
①
| HF
| Ka=6.8×10-4 mol?L-1
|
②
| CH3COOH
| Ka=1.7×10-5 mol?L-1
|
③
| HCN
| Ka=6.2×10-10 mol?L-1
|
④
| H2CO3
| Ka1=4.4×10-7mol?L-1
Ka2=4.7×10-11 mol?L-1
|
根据上述数据,回答下列问题:
(1)四种酸中酸性最强的是_____________,四种酸中酸性最弱的是_____________。
(2)写出H2CO3电离方程式是?、?。
(3)写出反应的方程式:足量的氢氟酸与碳酸钠溶液混合:___________?______,
足量的CO2通入NaCN溶液中:_________?_____。
参考答案:(1)氢氟酸,? HCN?
(2)H2CO3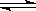 HCO3—+H+,? HCO3—
HCO3—+H+,? HCO3—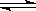 CO32—+H+
CO32—+H+
( 3)2HF+Na2CO3=2NaF+H2O+CO2↑,? NaCN+H2O+CO2= HCN+NaHCO3
本题解析:(1)电离常数越大,相应酸的酸性越强,所以根据电离常数可知,酸性最强的是氢氟酸,而最弱的是HCN。
(2)碳酸是二元弱酸,电离是分步进行的,所以电离方程式依次是
H2CO3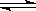 HCO3—+H+、HCO3—
HCO3—+H+、HCO3—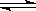 CO32—+H+。
CO32—+H+。
(3)由于氢氟酸的电离常数大于碳酸的电离常数,所以根据较强酸制取较弱的酸可知,反应的方程式是2HF+Na2CO3=2NaF+H2O+CO2↑;由于碳酸的第一步电离常数大于HCN的,但第二步小于HCN的,所以足量的CO2通入NaCN溶液中反应方程式是NaCN+H2O+CO2= HCN+NaHCO3。
本题难度:一般
2、选择题 常温下测得浓度均为0.1 mol·L—1的下列三种溶液的pH:
溶 质
| NaHCO3
| Na2CO3
| NaCN
|
pH
| 8.4
| 11.6
| 11.1
|
?
下列说法中错误的是
A.溶液中阳离子物质的量之和的关系为:Na2CO3>NaHCO3=NaCN
B.相同条件下的酸性:H2CO3>HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度会使c(HCO3—)/ c(CO32—)增大
参考答案:A
本题解析:A、溶液中阳离子物质的量之和,因三种溶液的体积不确定,无法比较物质的量的大小,错误;B、根据“越弱越水解”盐的水解规律,NaCN水解程度大于NaHCO3水解程度,所以酸性:H2CO3>HCN,正确;C、都存在水的电离平衡以及相应的弱酸根离子的水解平衡,正确;D、升高温度促进Na2CO3水解,平衡正向移动,会使c(HCO3—)/ c(CO32—)增大,正确。
本题难度:一般
3、选择题 能说明醋酸是弱电解质的事实是
A.醋酸水溶液能使湿润的蓝色石蕊试纸变红
B.醋酸和碳酸钠溶液反应放出二氧化碳
C.c(H+)相同的醋酸和盐酸相比较,醋酸溶液的浓度大
D.物质的量浓度和体积均相同的醋酸和盐酸可中和等物质的量的NaOH
参考答案:C
本题解析:电解质的强弱判断依据是该电解质的电离子程度。A、醋酸水溶液能使湿润的蓝色石蕊试纸变红,不能表明醋酸完全电离与否,错误;B、醋酸和碳酸钠溶液反应放出二氧化碳,只能表明醋酸电离子出氢离子的能力比碳酸强,但不能说明是完全电离与否,错误;C、c(H+)相同的醋酸和盐酸相比较,醋酸溶液的浓度大,表明盐酸的电离程度比醋酸的大,盐酸完全电离,而醋酸就只能是部分电离,正确;D、物质的量浓度和体积均相同的醋酸和盐酸可中和等物质的量的NaOH,说明盐酸跟醋酸能提供等量的氢离子,但不能说明是完全电离与否,错误。
本题难度:一般
4、选择题 氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A.1mol/L氢氰酸溶液的pH约为3
B.HCN易溶于水
C.10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应
D.HCN溶液的导电性一定比强酸溶液的导电性弱
参考答案:A
本题解析:弱电解质的特点是部分电离。所以1mol/L氢氰酸溶液的pH约为3即电离的c(H+)=0.001mol/L,能够说明HCN部分电离,A正确;HCN的电离程度与溶解性无关,B错误;HCN与等体积等浓度碱反应与电离无关,C错误;导电性与离子的浓度有关,D中没有指明酸的浓度,无法比较,D错误,故选A。
本题难度:一般
5、选择题 下列图示与对应的叙述相符的是
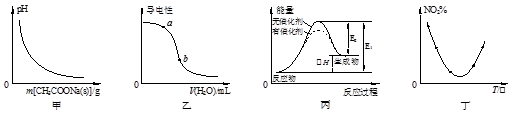
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2 (g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
参考答案:D
本题解析:A、向CH3COOH溶液中逐步加入CH3COONa固体,因为醋酸根离子浓度增大,所以醋酸的电离平衡逆向移动,pH增大,错误;B、醋酸的稀释过程中,氢离子浓度、醋酸根离子浓度均减小,导电性降低,pH增大,所以b>a,错误;C、催化剂只能改变活化能,不能改变反应热,所以丙图表示催化剂改变反应的活化能,错误;D、二氧化氮的含量最低时说明反应达到平衡状态,再升高温度,二氧化氮的含量增大,说明平衡逆向移动,则正反应是放热反应,则△H<0,正确,答案选D。
考点:考查对化学图像的分析,涉及盐的水解、弱电解质的电离、反应活化能、平衡的移动
本题难度:困难