1、选择题 在冶金工业上,常用电解法得到Na、Mg、Al等金属,其原因主要是……( )
A.这些金属的化合物熔点低
B.它们都是轻金属
C.它们的性质很活泼
D.此方法成本低
参考答案:C
本题解析:某些活泼金属或某些活泼非金属因从化合物中还原或氧化制取很难,故采用电解法。例如:(条件都是电解)
2NaCl=2Na+Cl2↑
MgCl2=Mg+Cl2↑
2Al2O3=4Al+3O2↑
2NaCl+2H2O=2NaOH+H2↑+Cl2↑
2KHF2=2KF+H2↑+F2↑
本题难度:一般
2、填空题 由美国通用原子能公司(GA)提出的碘硫循环被公认为是效率最高(预期转化率可达50%以上)、最有希望实现的热化学分解物质X的循环。其流程如下: ?
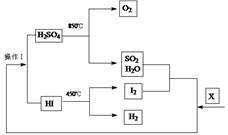
(1)物质X是_____________(填化学式);在此循环过程中,有一种物质,当作为反应物时只是还原剂,作为生成物时是还原产物,该化合物是__________。
(2)在实验室中进行蒸馏操作时,所需的玻璃仪器为蒸馏烧瓶、温度计、尾接管、锥形瓶、____________。
(3)氧缺位铁酸铜(CuFe2O4-x)可作上述流程中硫酸分解的催化剂。先在一定条件下,向Fe( NO3)3和Cu(NO3)2混合液中加入KOH,制得铁酸铜( CuFe2O4),此反应的化学方程式为:____________;然后在______(填一常见气体)保护下,高温煅烧2h得到CuFe2O3.86,试计算1 mol CuFe2O3.86中Fe2+的物质的量为____mol。
(4)硫酸分解随温度等变化规律的实验结果如图所示,表示没有使用催化剂的曲线是______(填图中数字)。

参考答案:(1)H2O?、SO2 (2)酒精灯、冷凝管
(3)2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O ?氮气? 0.28?(4)③
本题解析:(1)由流程图可以看出物质X为H2O,在循环过程中SO2当作为反应物时只是还原剂。当作为生成物时是还原产物。(2)在实验室中进行蒸馏操作时,所需的玻璃仪器为蒸馏烧瓶、温度计、尾接管、锥形瓶、冷凝管、酒精灯。(3)在一定条件下,向Fe( NO3)3和Cu(NO3)2混合液中加入KOH,制得铁酸铜( CuFe2O4),此反应的化学方程式为2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O。然后在N2的保护作用下煅烧即得到CuFe2O3.86.假设在1 mol CuFe2O3.86中Fe2+的物质的量为x,则Fe3+物质的量为(2-x).根据在化合物中正负化合价的代数和为0的原则,可得1×2+2×x+3×(2-x)=2×3.86.解得x=0.28mol.(4)若没有使用催化剂,则反应分解需要的温度高。有图像可知应该是③。
本题难度:一般
3、选择题 合成氨时既要使合成氨的产率增大,又要使反应速率加快,可采取的方法是( )。
①减压;②加压;③升温;④降温;⑤及时从平衡混合气中分离出NH3;⑥补充N2或H2;⑦加催化剂;⑧减小N2或H2的量
A.③④⑤⑦
B.②④⑥
C.仅②⑥
D.②③⑥⑦
参考答案:C
本题解析:合成氨反应N2(g)+3H2(g) 2NH3(g)的特点为:正反应放热且气体分子数减小。要使平衡向正反应方向移动且反应速率加快,应选C。
2NH3(g)的特点为:正反应放热且气体分子数减小。要使平衡向正反应方向移动且反应速率加快,应选C。
本题难度:简单
4、选择题 酸与碱完全中和时( )。
A.酸与碱的物质的量一定相等
B.酸所能提供的H+与碱所能提供的OH-的物质的量相等
C.酸与碱的质量相等
D.溶液呈中性
参考答案:B
本题解析:酸碱中和反应的实质是H++OH-=H2O。强酸与弱碱或强碱与弱酸完全中和后溶液不一定是中性。
本题难度:简单
5、选择题 下列气体中最易液化,适宜做致冷剂的是( ? )
A.N2
B.NH3
C.SO2
D.HCl
参考答案:B
本题解析:
本题难度:简单