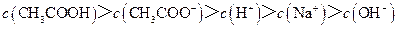1、选择题 常温下,下列物质的水溶液的PH大于7的是
A.Na2CO3
B.Na2SO4
C.NH4Cl
D.KCl
参考答案:A
本题解析:考查盐类的水解
Na2SO4与KCl两物质为强酸强碱盐,不水解,水溶液为中性,而Na2CO3为弱酸强碱盐,水解溶液呈碱性, NH4Cl为强酸弱碱盐,水解后溶液呈酸性,故选A
本题难度:一般
2、填空题 已知某溶液中只存在OH-、H+、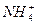 、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(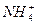 )>c(H+)>c(OH-)②c(Cl-)>c(
)>c(H+)>c(OH-)②c(Cl-)>c(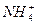 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c(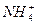 )>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(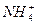 )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶液是_______________,上述四种离子的浓度的大小顺序为_______________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为_______________;若上述关系中④是正确的,则溶液中的溶质是_______________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好成中性,则混合前c(HCl)_________c(NH3·H2O)(填“大小”“小于”或“等于”)。
参考答案:(1)NH4Cl①(2)NH4Cl和NH3·H2ONH4Cl和HCl(3)小于
本题解析:据题意四种离子两两结合可得NH4Cl、NH3·H2O、HCl三种溶质。
(1)若溶液只溶解一种溶质,只有NH4Cl作为溶质时,溶液中才同时存在以上四种离子。因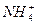 存在微弱的水解反应
存在微弱的水解反应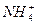 +H2O
+H2O NH3·H2O+H+,c(
NH3·H2O+H+,c(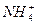 )减小,c(H+)>c(OH-),故溶液中c(Cl-)>c(
)减小,c(H+)>c(OH-),故溶液中c(Cl-)>c(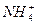
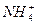 )>c(H+)>c(OH-)。
)>c(H+)>c(OH-)。
(2)若溶液中存在c(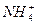 )>c(Cl-)>c(OH-)>c(H+),由c(OH-)>c(H+)可知溶液呈碱性,故溶液可由NH4Cl和NH3·H2O混合而得,即溶质为NH4Cl和NH3·H2O;若溶液中存在c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+),由c(OH-)>c(H+)可知溶液呈碱性,故溶液可由NH4Cl和NH3·H2O混合而得,即溶质为NH4Cl和NH3·H2O;若溶液中存在c(Cl-)>c(H+)>c(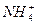 )>c(OH-),由c(H+)>c(
)>c(OH-),由c(H+)>c(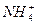 )可知溶液的酸性大于纯NH4Cl溶液的酸性,故溶液可由NH4Cl和盐酸混合而得。
)可知溶液的酸性大于纯NH4Cl溶液的酸性,故溶液可由NH4Cl和盐酸混合而得。
(3)若NH3·H2O和盐酸等体积混合后,溶液呈中性,则有c(H+)=c(OH-),c(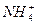 )=c(Cl-)n(
)=c(Cl-)n(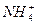 )=n(Cl-),因溶液中有未反应的NH3·H2O,则混合前n(NH3·H2O)>n(HCl)c(NH3·H2O)>c(HCl)。
)=n(Cl-),因溶液中有未反应的NH3·H2O,则混合前n(NH3·H2O)>n(HCl)c(NH3·H2O)>c(HCl)。
本题难度:简单
3、选择题 100℃时,下列各溶液中,离子的物质的量浓度关系正确的是:
A.pH=11的氨水中:c(OH-)=3.0mol·L-1
B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)=c(CH3COO-)
C.pH=2的稀盐酸中,c(H+)=c(Cl-)
D.pH=8的Na2SO3溶液中,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
参考答案:B
本题解析:A、没有确定溶液的温度,因此pH=11的氨水中c(OH-)不一定等于3.0mol·L-1,A不正确;B、根据电荷守恒可知c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),溶液显中性c(OH-)=c(H+),所以c(Na+)=c(CH3COO-),B正确;C、根据电荷守恒可知pH=2的稀盐酸中,c(H+)=c(Cl-) + c(OH-),C不正确;D、pH=8的Na2SO3溶液中显碱性,则c(Na+)>c(SO32-)>c(OH-) >c(HSO3-),D不正确,答案选B。
本题难度:一般
4、选择题 浓度均为0.1 mol·L-1的下列溶液,其pH由小到大的排列顺序是
①NaHCO3溶液?②NaHSO4溶液?③NaCl溶液?④AlCl3溶液?⑤NaClO溶液
A.① < ② < ③ < ④ < ⑤
B.④ < ② < ① < ③ < ⑤
< ⑤
C.② < ④ < ③ < ① < ⑤
D.② < ④ < ① < ③ < ⑤
参考答案:C
本题解析:略
本题难度:一般
5、选择题 常温下,用 0.1000 mol·L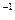 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L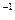
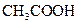 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
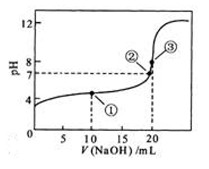
A.点①所示溶液中:
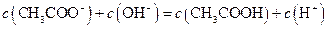
B.点②所示溶液中:
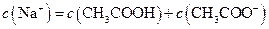
C.点③所示溶液中:
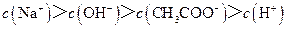
D.滴定过程中可能出现: