|
高中化学知识点讲解《影响盐类水解的因素》典型例题(二)
2020-08-13 06:08:05
【 大 中 小】
|
1、选择题 下列关系式不正确的是
A.常温下pH=2的甲酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(HCOO-)> c(OH-) >c(H+)
B.0.1mol·L-1Na3PO4溶液中:c(OH-)=c(H+)+c(HPO42-)+2c(H2PO4-)+3c(H3PO4)
C.0.4mol·L-1Ba(OH)2溶液与0.3mol·L-1NaHCO3溶液等体积混合:
c(OH-)>c(Na+)>c(Ba2+)>c(CO32-)
D.1L0.3mol·L-1NaOH溶液吸收标准状态下4.48LCO2:
| c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
参考答案:D
本题解析:略
本题难度:简单
2、选择题 下列说法中正确的是( )
A.在Na3PO4溶液中,c(Na+)是c(PO43-)的3倍
B.pH为3的盐酸中,其c(H+)是pH为1的盐酸中c(H+)的3倍
C.0.1 mol·L-1KOH溶液和0.1 mol·L-1氨水中,其c(OH-)相等
D.在25℃时,无论是酸性、碱性还是中性的稀溶液中,其c(H+)和c(OH-)的乘积都等于1×10-14
参考答案:D
本题解析:A.PO43-水解,c(Na+)>3c(PO43-);B.pH为3的盐酸中c(H+)=10-3mol·L-1,而pH=1的盐酸中c(H+)=10-1 mol·I-1,前者是后者的;C.氨水为弱电解质,部分电离;D.水的离子积适用于纯水和稀的电解质水溶液。25℃时其值为1×10-14。
本题难度:一般
3、填空题 物质A--E都是由下表中的离子组成的,常温下各物质从1 mL稀释到1000 mL,pH的变化如甲图所示,其中A 与D反应得到E。请回答
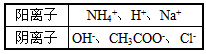
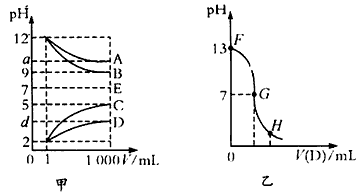
(1)根据甲图中各物质的pH变化关系,写出下列物质的化学式:B__________,D___________。
(2)甲图中a>9的理由是____________________。
(3)另取浓度为c1的B溶液25 mL,向其中逐滴滴加 0.2 mol/L的D溶液,滴定过程中溶液pH的变化曲线如 乙图所示。
①q为____________;
②G点溶液呈中性,则加入D溶液的体积V_________ (填“>”“<”或“=”)12.5 mL;
③常温下B、C溶液的pH分别是a、b且a +b=13,则将B、C混合恰好完全反应时所消耗B、C溶液的体积比 VB:VC=_____________。
参考答案:(1)NaOH;CH3COOH
(2)A是氨水,稀释平衡向电离的方向移动,溶液中OH-的浓度没有下降到原来的千分之一
(3)①0.1mol/L;②>;③10:1
本题解析:
本题难度:一般
4、选择题 KOH溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是
A.c(K+)>c(OH-)>c(A-)>c(H+)
B.c(K+)>c(A-)>c(OH-)>c(H+)
C.c(K+)>c(A-)>c(H+)>c(OH-)
D.c(K+)>c(H+)>c(A-)>c(OH-)
参考答案:B
本题解析:略
本题难度:简单
5、选择题 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
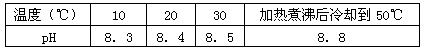
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为________________。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_________(填“大于”或“小于”)NaHCO3。
(3)丙同学认为甲、乙的判断都不充分。丙认为:只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则_________(填“甲”或“乙”)判断正确。试剂X是_________(填序号)。
?A.Ba(OH)2溶液 B.BaC12溶液 C.NaOH溶液 D.澄清的石灰水
将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则_____________ (填“甲”或“乙”)判断正确。
参考答案:(1)HCO3-+H2O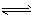 H2CO3+OH- H2CO3+OH-
(2)大于
(3)乙;B?;甲
本题解析:
本题难度:一般
|