1、选择题 欲使0.1 mol·L-1的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减小,其方法是( )
A.通入CO2
B.加入NaOH固体
C.通入HCl
D.加入饱和石灰水溶液
参考答案:D
本题解析:在NaHCO3溶液中存在如下平衡: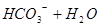 ?
?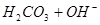 ,
,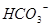 ?
?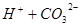 所以,A错,通入CO2气体溶液中碳酸浓度增大,平衡左移,c(H+)、c(CO32-)、c(HCO3-)都增多;B错,加入NaOH固体,能与氢离子反应,平衡右移,c(H+)减少,c(CO32-)增多,c(HCO3-)减少;C错,能入HCL,溶液中氢离子浓度增多,c(CO32-)、c(HCO3-)都减小;D正确;
所以,A错,通入CO2气体溶液中碳酸浓度增大,平衡左移,c(H+)、c(CO32-)、c(HCO3-)都增多;B错,加入NaOH固体,能与氢离子反应,平衡右移,c(H+)减少,c(CO32-)增多,c(HCO3-)减少;C错,能入HCL,溶液中氢离子浓度增多,c(CO32-)、c(HCO3-)都减小;D正确;
本题难度:一般
2、选择题 物质的量浓度相同的下列溶液中,NH4+浓度最大的是
A.NH4Cl
B.NH4HCO3
C.CH3COONH4
D.NH4HSO4
参考答案:D
本题解析:由于NH4++2H2O=NH3·H2O+H3O+,可知,A选项,既不促进也不抑制水解。B选项,HCO3?-水解大于电离,故产生大量氢氧根,促进水解,铵根浓度降低。C选项,CH3COO-水解,产生大量氢氧根,促进铵根水解,铵根浓度降低。D选项,硫酸氢根完全电离,产生大量氢离子,抑制水解。故D选项中铵根离子浓度最大。
本题难度:一般
3、填空题 把AlCl3(aq)蒸干灼热,最后得到的固体产物是什么?(用化学方程式表示,并配以必要的文字说明)?。
参考答案:AlCl3(aq)中存在下列水解平衡:
AlCl3+3H2O Al(OH)3+3HCl
Al(OH)3+3HCl
正反应是一个吸热反应,受热平衡向正反应方向移动。蒸干过程中,HCl比H2O更易逸出,HCl的逸出,使得AlCl3的水解加剧,生成Al(OH)3沉淀;同时,也有部分Al(OH)3发生了分解反应。灼烧所得固体时,Al(OH)3全部分解:
Al(OH)3 Al2O3+3H2O↑
Al2O3+3H2O↑
最后所得固体为Al2O3。
本题解析:先写出AlCl3的水解方程式。再根据水解反应吸热判定受热条件下AlCl3水解平衡移动的方向,并判定H2O、HCl谁更易逸入空气。最后根据弱碱不稳定,可知灼烧产物是Al2O3。
本题难度:一般
4、选择题 在H2O+CH3COO-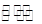 CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
A.加入NaOH固体
B.加入冰醋酸
C.增大压强
D.升高温度
参考答案:D
本题解析:加入AB使水解平衡逆向移动,C增大压强无影响;D升温促进水解平衡正向移动。
本题难度:一般
5、选择题 已知某温度下0.1mol/L的NaHB(强电解质)溶液中c(H+)>c(OH-),则下列关系一定正确的是(? )
A.c(Na+)=c(HB-)+2c(B2-)+c(OH-)
B.c(Na+)=0.1mol/L≥c(B2-)
C.c(H+)·c(OH-)=10-14
D.溶液的PH等于1
参考答案:B
本题解析:由NaHB是强电解质和c(H+)>c(OH-),但并不知道HB-是完全电离还是部分电离,只知可能完全电离或部分电离时应电离程度大于水解程度,故B正确,而D错误;依据电荷守恒知A错;又C项中某温度并非是常温。
本题难度:一般