1、选择题 1 molCaCl2里含有的微粒数正确的是
A.3 mol离子
B.1 mol分子
C.1个Ca2+
D.6.02×1023个Cl-
参考答案:A
本题解析:阴、阳离子总物质的量为3 mol.
本题难度:一般
2、实验题 将煤焦油中的苯、甲苯和苯酚进行分离,可采用如下图所示方法和操作:
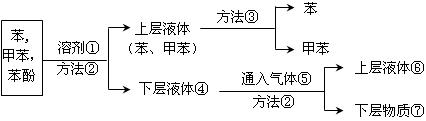
(1)写出物质①和⑤的分子式:?①??⑤?。
(2)写出分离方法②和③的名称:②??③?。
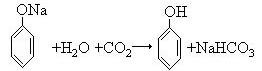
(3)下层液体④通入气体⑤反应的化学方程式。?。
(4)分离出的苯酚含在?中(填编号)。
参考答案:(1)①NaOH?⑤CO2?(2)②分液?③蒸馏
(3)
本题解析:略
本题难度:一般
3、填空题 为了除去NaCl溶液中少量的MgCl2、Na2SO4,从稀盐酸,Na2CO3,K2CO3,Ba(NO3)2,Ba(OH)2溶液中,选择A、B、C?3种试剂,按图中步骤进行操作:
溶液
滤液滤液较纯净的NaCl溶液
(1)下列试剂的化学式A______?C______
(2)加入过量A的原因是______,有关反应的离子方程式是______,
______
(3)加入过量B有关反应的离子方程式是______.
参考答案:(1)除去NaCl溶液中的少量MgCl2和MgSO4,可看成把Mg2+、SO42-沉淀而除去,因此选择所提供试剂中的Ba(OH)2可同时沉淀掉Mg2+、SO42-离子;反应生成的BaCl2和过量的Ba(OH)2可加入所选试剂中的Na2CO3而除去;最后通过滴加盐酸可把过量的Na2CO3及反应生成的NaOH同时反应掉而生成NaCl;分析判断A为Ba(OH)2;C为HCl;
故答案为:Ba(OH)2;HCl;
(2)为确保混合溶液中的MgCl2和MgSO4全部反应而沉淀掉,应加入过量的Ba(OH)2,生成Mg(OH)2、BaSO4;反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓?Ba2++SO42-=BaSO4↓;
故答案为:为了除尽Mg2+和SO42-;Mg2++2OH-=Mg(OH)2↓?Ba2++SO42-=BaSO4↓;
(3)为确保溶液是的Ba2+全部沉淀而除去,应加入过量的Na2CO3到沉淀不再产生;反应生成碳酸钡沉淀、氯化钠、氢氧化钠;反应的离子方程式为:Ba2++CO32-=BaCO3↓;
故答案为:Ba2++CO32-=BaCO3↓;
本题解析:
本题难度:简单
4、选择题 下列关于实验原理或操作的叙述中,不正确的是(? )
A.从碘水中提取单质碘时,不能用无水乙醇代替CCl4
B.乙醇发生催化氧化反应,产物可用新制的Cu(OH)2悬浊液检验
C.用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
D.实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法
参考答案:C
本题解析:乙醇和水互溶,萃取单质碘时不能用无水乙醇代替CCl4,A正确;乙醇催化氧化产物乙醛,加热条件下与新制的Cu(OH)2悬浊液反应,生成红色沉淀,所以B正确;应该用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质,C错误;乙酸可以和生石灰反应,生成醋酸钙不挥发,选项D正确。
本题难度:简单
5、选择题 乙烯中混有SO2气体,欲除去SO2,得到较纯净的乙烯,最好依次通过下列哪组试剂的洗气瓶(? )
A.酸性KMnO4溶液、浓H2SO4
B.溴水、浓H2SO4
C.浓H2SO4、酸性KMnO4溶液
D.NaOH溶液、浓H2SO4
参考答案:D
本题解析:乙烯和SO2均能被酸性高锰酸钾溶液氧化,也都能和溴水反应。但乙烯不能和碱液反应,所以欲除去SO2,得到较纯净的乙烯,最好依次通过NaOH溶液(出去SO2)、浓H2SO4(干燥乙烯),答案选D。
点评:在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:简单