1、选择题 17.若50滴水正好是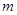 mL,水在该条件下密度为1g/ mL.则1滴水所含的分子数是(?)
mL,水在该条件下密度为1g/ mL.则1滴水所含的分子数是(?)
A.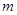 ×50×18×6.02×1023
×50×18×6.02×1023
B.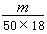 ×6.02×1023
×6.02×1023
C.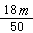 ×6.02×1023
×6.02×1023
D.

参考答案:B
本题解析:1滴的体积是 ,所以1滴水所含的分子数是
,所以1滴水所含的分子数是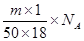 ,答案选B。
,答案选B。
本题难度:一般
2、计算题 (14分)将5.6g铁粉放入200ml的某浓度的盐酸中,恰好完全反应,求:
(1)铁粉的物质的量是?
(2)写出其反应的离子方程式
(3)盐酸的浓度(计算过程):
(4)生成H2在标准状况下的体积为______
(5)如果把盐酸改为稀硫酸,则稀硫酸的浓度为________。
参考答案:(1)0.1mol?(2分无单位0分)
(2) Fe + 2H+ = H2# + Fe2+(3分无气体符号扣1分)
(3) Fe? +? 2HCl =? H2# +? FeCl2
1? 2? 1
0.1mol? 0.2mol? 0.1mol?(2分)
C(HCl) = 0.2mol/0.2L? =" 1" mol/L?(2分)(合理即可得4分,无过程0分)
(4)2.24L?(2分无单位0分)?(5) 0.5 mol/L (3分无单位0分)
本题解析:考查根据方程式及有关物质的量的计算。
(1)铁的相对原子质量是56,所以根据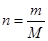 可知,n=5.6g÷56g/mol=1.0mol。
可知,n=5.6g÷56g/mol=1.0mol。
(2)铁是活泼的金属,能和盐酸反应置换出氢气,离子方程式为Fe + 2H+ = H2# + Fe2+。
(3) Fe? +? 2HCl =? H2# +? FeCl2
1? 2? 1
0.1mol? 0.2mol? 0.1mol?
c(HCl) = 0.2mol/0.2L? =" 1" mol/L?
(4)根据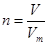 可知,氢气的体积是V=0.1mol×22.4L/mol=2.24L。
可知,氢气的体积是V=0.1mol×22.4L/mol=2.24L。
(5)如果把盐酸改为稀硫酸,则稀硫酸的物质的量是0.1mol,浓度是c(H2SO4) = 0.1mol/0.2L? =" 0.5" mol/L 。
本题难度:一般
3、选择题 NA表示阿伏加德罗常数的值,下列说法中正确的是
A.7.8 g Na2S和7.8 g Na2O2中含有的阴离子数目均为0.1 NA
B.0.1mol·L-1的NaHSO4溶液中含有阳离子的物质的量为0.2mol
C.常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L
D.l.8 g188O2分子与1.8 g188O3分子中含有的中子数不相同
参考答案:A
本题解析:略
本题难度:一般
4、选择题 实验中需2 mol·L-1的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是
A.1000mL,212g
B.1000mL,201.4g
C.950mL,201.4g
D.950mL,212g
参考答案:A
本题解析:实验室没有950mL容量瓶,所以本题实质是配制1000mL2mol/L碳酸钠溶液,需要碳酸钠质量为212g。
点评:容量瓶常见规格:100mL、250mL、500mL、1000mL。
本题难度:一般
5、选择题 NA表示阿伏加德罗常数的值,下列说法正确的是?( )
A.5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA
C.7.8gNa2O2中含有的阴离子数等于0.1NA
D.0.5mol雄黄(As4S4,结构如右图)含有NA个S—S键[
