1、填空题 (10分)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断:
(1)蓄电池的负极是______,其电极反应式为______。
(2)蓄电池的正极是______,其电极反应式为______。
(3)蓄电池工作时,其中电解质溶液的pH______(增大、减小、不变)。
(4)实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得Cl2?0.050mol,这时电池内消耗的H2SO4的物质的量至少是?。
参考答案:
(1)Pb? Pb - 2e- +SO42-=PbSO4?
(2)PbO2?PbO2 + 4H++SO4 +2e-=? PbSO4?+ 2H2O
(3)增大
(4)1mol
本题解析:由总反应中的元素化合价的升降可知
Pb在负极失电子:Pb - 2e- +SO42-=PbSO4
PbO2在正极得电子:PbO2 + 4H++SO4 +2e-=PbSO4 + 2H2O
电池工作过程中,消耗硫酸,电解质溶液的酸性减弱,pH增大
(4)电解食盐水:2NaCl+2H2O=2NaOH+H2↑+Cl2↑,当制得0.050mol氯气时,电路中电子的转移为0.1mol,而在电池内部(反应中有两个电子转移),必定耗硫酸最少0.1mol
本题难度:简单
2、选择题 铅蓄电池是广泛应用于汽车、柴油机车等的启动电源。产生电能时的电极反应分别为:
Pb+SO42
参考答案:
本题解析:
本题难度:困难
3、填空题 (9分)下图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
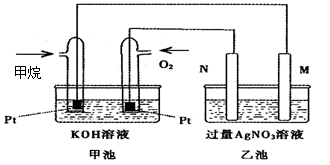
(1)N的电极反应式为 :
乙池的总化学方程式是 ,
加入甲烷的铂电极的电极反应式为 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下);若此时乙池溶液的体积为200mL,则乙池中溶液的H+的浓度为 。
参考答案:(1)4OH--4e-=O2↑+2H2O(1分);
4AgNO3+2H2O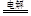 4Ag+4HNO3+2O2↑(2分);
4Ag+4HNO3+2O2↑(2分);
CH4-8e-+10OH-=CO32-+7H2O(2分)
(2)0.224(2分);0.2mol/L(2分)
本题解析:(1)甲池是以氢氧化钾溶液为电解液的甲烷燃料电池,通入甲烷的一极为原电池的负极,电极反应式为:CH4-8e-+10OH-=CO32-+7H2O,通入氧气的一极为原电池的正极,电极反应式为:O2 + 2H2O + 4e-=4OH-;乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,为电解池的阳极,应为石墨材料,N为阳极,电极反应式是4OH--4e-=O2↑+2H2O,M为阴极,电极反应式为Ag++e-=Ag,电解的总反应为:4AgNO3+2H2O 4Ag+4HNO3+2O2↑;(2)n(Ag)=0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,电极反应式为:O2 + 2H2O + 4e- = 4OH-,则消耗n(O2)=0.01mol,
4Ag+4HNO3+2O2↑;(2)n(Ag)=0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,电极反应式为:O2 + 2H2O + 4e- = 4OH-,则消耗n(O2)=0.01mol,
V(O2)=0.224L;根据反应4AgNO3+2H2O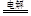 4Ag+4HNO3+2O2↑知,n(H+)=n(HNO3)=0.04mol,又溶液的体积为200mL,则c(H+)=0.2mol/L。
4Ag+4HNO3+2O2↑知,n(H+)=n(HNO3)=0.04mol,又溶液的体积为200mL,则c(H+)=0.2mol/L。
考点:考查原电池原理、燃料电池及电解原理的应用。
本题难度:困难
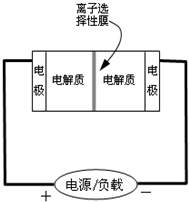
4、选择题 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3
Na2S4+3NaBr
①充电的过程中当0.1molNa+通过离子交换膜时,导线通过0.1mol电子
②电池放电时,负极反应为:3NaBr-2e-=NaBr3+2Na+
③充电过程中钠离子从右到左通过离子交换膜
④放电过程中钠离子从右到左通过离子交换膜
上述关于此电池说法正确的是( )
A.①②③④
B.②③④
C.②③
D.①④