1、选择题 在化学反应A(g)+3B(g)?2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是( )
A.vA=vB
B.vA=2vC
C.3vB=vC
D.vB=3vD
参考答案:根据化学反应速率之比等化学计量数之比可知:v(A):v(B):v(C):v(D)=1:3:2:1,
A.3vA=vB,故A错误;
B.2vA=vC,故B错误;
C.2vB=3vC,故C错误;
D.vB=3vD,故D正确,
故选D.
本题解析:
本题难度:一般
2、选择题 将0.6 mol A和0.5 mol B充入0.4L密闭容器中发生2A(g)+B(g)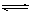 mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是(?)
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是(?)
A.A、B均转化了20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1 mol·L-1·min-1
D.平衡时混合物总物质的量为1 mol
参考答案:B
本题解析:考查可逆反应的有关计算。根据E的反应速率可知,生成E的物质的量是0.1 mol·L-1·min-1×0.4L×5min=0.2mol,所以计量数m=1。则
2A(g)+B(g)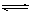 D(g)+E(g)
D(g)+E(g)
起始量(mol)? 0.6? 0.5? 0? 0
转化量(mol)? 0.4? 0.2? 0.2? 0.2
平衡量(mol)? 0.2? 0.3? 0.2? 0.2
所以A和B的转化率分别为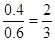 、
、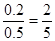 ,因此选项A不正确。
,因此选项A不正确。
因为速率之比是相应的化学计量数之比
所以5min内用A表示的平均反应速率为0.1 mol·L-1·min-1×2=0.2 mol·L-1·min-1
平衡时混合物总物质的量为0.2mol+0.3mol+0.2mol+0.2mol=0.9mol
所以答案选B。
本题难度:一般
3、填空题 100mL浓度为2mol?L-1的硫酸与过量锌粒反应,为加快反应速率,又不影响生成氢气的总量,可采取的方法是?。
A.加入适量的6mol?L-1的硫酸
B.将锌粒改为锌粉
C.加入适量的KCl溶液
D.升高溶液温度E.加入适量硫酸铜
参考答案:BDE (2分,错一个扣1分)
本题解析:略
本题难度:一般
4、选择题 下列反应中生成H2的速率最快的是
[? ]
金属?
酸溶液
温度
A.
Mg
0.5mol/L H2SO4
20℃
B.
Fe
1 mol/L HCl
20℃
C.
Mg?
2 mol/L HCl
20℃
D.
Mg
1 mol/L H2SO4
30℃
参考答案:D
本题解析:
本题难度:一般
5、简答题 低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.已知:CO(g)+H2O(g)?H2(g)+CO2(g)△H=a?kJ?mol-1的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 427 | 700 | 800
平衡常数
9.94
9
b
0.64
|
(1)a______0?(填“<”或“>”).若到达平衡后升高温度,则CO的转化率将______,正反应速率______(填“增大”、“减小”或“不变”).
(2)若在427℃时进行,且CO、H2O的起始浓度均为0.01mol/L,在该条件下,CO的最大转化率为______.
(3)700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | H2O/mol
0
1.20
0.60
t1
0.80
t2
0.20
|
保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=______mol;b=______.
参考答案:(1)由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,则正反应为放热反应,故a>0,
平衡向逆反应移动,CO的转化率减小,升高温度反应速率加快,故正反应速率增大,
故答案为:>,减小,增大;
(2)到达平衡时转化率最大,令平衡时CO的浓度变化量为x,则:
?CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol/L):0.01? 0.01?0? 0
变化(mol/L):x? x? x? x
平衡(mol/L):0.01-x?0.01-x? x? x
故x×x(0.01-x)×(0.01-x)=9,解得x=0.0075
故CO的转化率为0.0075mol/L0.01mol/L×100%=75%
故答案为:75%;
(3)由表中数据可知,t1时刻,△n(CO)=1.2mol-0.8mol=0.4mol,根据方程式CO(g)+H2O(g)?H2(g)+CO2可知,△n(H2O)=0.4mol,故此时n(H2O)=0.6mol-0.4mol=0.2mol,t2时刻水的物质的量为0.2mol,故t1时刻反应达平衡,
?CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol):1.2? 0.6?0? 0
变化(mol):0.4?0.4? 0.4? 0.4
平衡(mol):0.8? 0.2? 0.4?0.4
故该温度下平衡常数为:0.4×0.40.8×0.2=1
起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,令二氧化碳的物质的量为y,则:
? ?CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol):0.6?1.2?0? 0
变化(mol):y? y?y? y
平衡(mol):0.6-y? 1.2-y? y? y
所以y×y(0.6-y)×(1.2-y)=1,解得y=0.4,
故答案为:0.4,1.
本题解析:
本题难度:一般