|
|
|
高中化学知识点归纳《盐类水解的原理》试题强化练习(2019年最新版)(一)
2020-08-13 06:21:10
【 大 中 小】
|
1、选择题 等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是
A.NH4Cl
B.NH4HCO3
C.NH4HSO4
D.NH4NO3
|
2、选择题 常温下a mol·L-1 CH3COOH稀溶液和bmol·L-1KOH稀溶液等体积混合,下列判断一定错误的是( )
A.若c(OH-)>c(H+),则a=b
B.若c(K+)>c(CH3COO-),则a>b
C.若c(OH-)=c(H+),则a>b
D.若c(K+)<c(CH3COO-),则a<b
|
3、选择题 下列物质中,水解的最终产物不能发生银镜反应的是( ? )
A.蔗糖
B.油脂
C.纤维素
D.淀粉
4、选择题 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg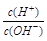 ,室温下实验室用0.01 mol/L的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述错误的是
,室温下实验室用0.01 mol/L的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述错误的是
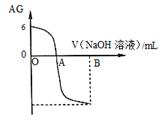
A.A点时加入氢氧化钠溶液体积为20 mL
B.室温时0.01 mol/L的醋酸溶液pH=4
C.OA段溶液中:c(CH3COO-)> c(CH3COOH)
D.若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH) + c(H+) = c(OH-)
5、填空题 (共8分)A、B、C、D、E均为可溶于水的固体,组成他们的离子有
阳离子
| Na+ Mg2+ Al3+ Ba2+
|
阴离子
| OH- Cl- CO32- SO42- HSO4-
|
分别取它们的水溶液进行实验,结果如下:①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
(1)据此推断它们是(写化学式)A
;B
;C
;D
;E
。
(2)写出④中反应的离子方程式:
。
(3)A溶液中各种离子浓度由大到小的顺序为
。
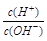 ,室温下实验室用0.01 mol/L的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述错误的是
,室温下实验室用0.01 mol/L的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述错误的是