| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《物质的量》高频考点预测(2019年最新版)(十)
参考答案:B 本题解析:含有的是3.01×1022个分子的物质的量为 本题难度:一般 2、选择题 溶液中只含K+、Fe2+、Cl-、SO42-四种离子.已知K+、Fe2+、Cl-的个数比为3:2:1,则溶液中Fe2+与SO42-的个数比为 |
参考答案:A
本题解析:设K+、Fe2+、Cl-的物质的量分别为3mol,2mol,1mol。根据电荷守恒可以计算出硫酸根离子为3mol。所以溶液中Fe2+与SO42-的个数比为2:3
考点:电荷守恒
点评:本题难度不高,抓住选择题的做题技巧,可以把计算过程简略。
本题难度:一般
3、计算题 (13分)在标准状况下,将22.4L HCl 气体溶于63.5mL水中,所得盐酸的密度为1.18g/cm3。
回答下列问题:
(1)所得盐酸的质量分数浓度和物质的量浓度(列式计算)?
(2)现需480mL2.0mol/L的盐酸需用量筒量取?mL上述盐酸并选用?mL的容量瓶来配制;若配制过程中洗涤量取上述盐酸的量筒,并将洗涤液转移到容量瓶,则所配盐酸的浓度?2.0mol/L(填>、<或=)。
(3)现取不纯的Na2CO3样品ag(含少量NaHCO3和H2O)于100mL2.0mol/L过量的盐酸中,充分反应后,再加入50mL1.0mol/L的NaOH溶液后呈中性。蒸发中和后的溶液最终得到固体?g。
参考答案:(1)(4分)? 36.5%? 11.8mol/L?(只要写成主要量方程计算即可)
(2)(6分)? 84.7 ;500 ;>?;(3)(3分)? 11.7
本题解析:(1)标准状况下,22.4L HCl 气体的物质的量是22.4L÷22.4L/mol=1.0mol,质量是36.5g。所以溶液的质量是63.5g+36.5g=100g,所以溶液的质量分数是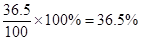 ;溶液的体积是100g÷1.18g/ml=84.75ml,所以浓度是
;溶液的体积是100g÷1.18g/ml=84.75ml,所以浓度是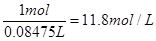 。
。
(2)由于容量瓶的规格没有480ml的,所以应该配制500ml,则需要浓盐酸的体积是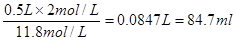 ;若配制过程中洗涤量取上述盐酸的量筒,并将洗涤液转移到容量瓶,则溶质的物质的量将增加,导致浓度偏高。
;若配制过程中洗涤量取上述盐酸的量筒,并将洗涤液转移到容量瓶,则溶质的物质的量将增加,导致浓度偏高。
(3)最终溶液中的溶质是氯化钠,根据钠原子守恒可知,氯化钠的物质的量是0.05L×1.0mol/L=0.05mol,所以质量是0.05mol×58.5g/mol=11.7g。
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的数值,下列说法正确的是?
A.lmol Na2O2晶体中共含有4NA个离子
B.常温常压下16gO2和O3混合气体含有NA个氧原子
C.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒
D.17g的氢氧根离子中含有的电子数为9NA
参考答案:B
本题解析:略
本题难度:一般
5、选择题 只给出下列甲中和乙中对应的量,不能组成一个求物质的量公式的是
| 选项 | 甲 | 乙 |
| A | 物质的粒子数 | 阿伏加德罗常数 |
| B | 标况下气体的体积 | 标况下气体摩尔体积 |
| C | 固体的体积 | 固体的密度 |
| D | 溶液的物质的量浓度 | 溶液的体积 参考答案:C 本题解析:考查物质的量的有关计算。根据 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《物质的分离.. | |