1、选择题 可用来鉴别甲烷和乙烯,又可用来除去甲烷混有的少量乙烯的是
[? ]
A.混合气通过成饱和食盐水的洗气瓶
B.混合气通过盛足量溴水的洗气皮瓶
C.混合气通过盛水的洗气瓶
D.混合气和氯化氢混合
2、选择题 用NA表示阿伏加德罗常数的值.下列叙述中不正确的是
A.1L?0.5?mol?L-1的MgCl2溶液,含有Cl-数为?NA
B.标准状况下,11.2?L?CCl4中含有的分子数目为0.5NA
C.常温常压下,18?g?H2O中含有的原子总数为3NA
D.质量为32g的O3和O2的混合物中含有的氧原子数为2NA
3、实验题 (18分)铁、铝与冷浓硫酸可发生钝化现象,故工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)m g放入稀硫酸中,铁钉表面现象为?。取出铁钉用蒸馏水洗涤后干燥,置于冷浓硫酸中,10分钟后移入稀硫酸溶液中,观察,开始一段时间铁钉表面无明显变化,其原因是?。
(2)另称取铁钉放入足量冷浓硫酸中,加热,充分反应后,过滤得到、溶液X并收集到气体Y。
①甲同学认为X中除铁单质外外还可能含有Fe3+、Fe2+。若要确认其中的Fe2+,可选择试剂为_________________,现象是_______________________________________________。
②乙同学根据氧化还原反应原理,认为气体中必然含有SO2,取336ml(标准状况)气体Y通入足量溴水中,发生反应离子方程式为:________________________________________。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为?。
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)加以验证。
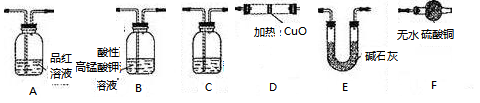
(3)装置的连接顺序是________________________________。
(4)除了C中的现象证明Q存在为,认为气体Y中还含有Q的理由是?(用化学方程式表示)。
(5)混合气体可能由H2、Q、SO2中的一种或多种气体组成,经测定其含氧量为50%,则该气体可能:①仅由SO2组成;②由H2和Q组成;③由H2和SO2组成;④由Q、SO2组成;⑤由H2、Q和SO2组成;其中可能正确的有( )
A.①
B.②③④
C.①②⑤
D.③④⑤
4、选择题 下列有关除杂质(括号中为杂质)的操作中,错误的是
A.福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
B.乙醇(水):加入足量生石灰,蒸馏,收集馏出物
C.苯(苯酚):加溴水,振荡,过滤除去沉淀
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层
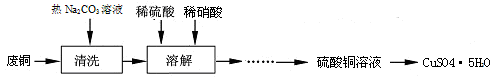
5、填空题 (15分)工业中利用废铜(含有锌、铝等)制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中加热,使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L—1计算)。
?
| 开始沉淀的pH
| 沉淀完全的pH
| 沉淀溶解的pH
|
Cu2+
| 4.4
| 6.4
| ?
|
Al3+
| 3.0
| 5.0
| 10
|
Zn2+
| 5.9
| 8.9
| 11
|
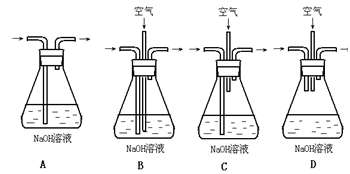
(1)①为了节约原料,硫酸和硝酸的物质的量之比最佳为??;该反应中产生尾气污染空气,请选择下图中合适的装置吸收尾气?。?
②由表可知Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2—,请写出金属锌与氢氧化钠溶液反应的离子方程式?
(2)为了符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:空气为氧化剂法
将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加入物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全。已知:Ksp[Fe((OH)3]≈10-38,然后过滤、浓缩、结晶。
请回答下列问题:
①方案为了使铁离子全部沉淀,应调节pH至少为??。
②方案中甲物质可选用的是??
A.CaO ? B.NaOH ? C.CuCO3 ? D.Cu2(OH) 2CO3?E.Fe2(SO4) 3
③方案中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因??。
第二组:过氧化氢为氧化剂法
将铜粉放到 1.5 mol·L-1的足量稀硫酸中,控温在50℃加入10%的足量H2O2反应0.5 h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 。
请回答下列问题:
④用过氧化氢为氧化剂法比流程中采用硝酸和硫酸溶解的优点是?。
⑤用少量95%的酒精淋洗的目的是??。
(3)废铜溶解后经过一系列操作得到硫酸铜溶液,补充完整由溶解液制备纯净硫酸铜溶液的实验步骤??。