1、选择题 下列叙述正确的是
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1mol任何气体所占的体积为22.4L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
参考答案:B
本题解析:气体体积大小主要由两个因素决定,一是分子数的多少,二是分子间的平均距离,当温度和压强一定时,由分子数大小决定,A错,B正确;C中,22.4L是指标准状况下,1mol气体的体积,C错;状态不同,不同的气体,体积可能相同。
本题难度:一般
2、选择题 相对分子质量为M的气态化合物V L(标准状况),溶于mg水中,得到质量分数为w%的溶液,物质的量浓度为cmol/L,密度为ρg·cm-3,则下列说法正确的是
[? ]
A.相对分子质量M=
B.物质的量浓度c=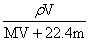
C.溶液的质量分数w%=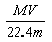
D.溶液密度ρ=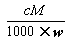
参考答案:A
本题解析:
试题分析:
解:
A、VL的气体的物质的量是V/22.4mol,所以气体的质量是 VM/22.4g,则w%= VM/22.4/( VM/22.4+m),解得M=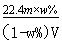 ,正确;B、根据C=1000ρw%/M,得C=1000
,正确;B、根据C=1000ρw%/M,得C=1000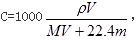 ,错误;C、w%= VM/22.4/( VM/22.4+m)=MV/(MV+22.4m),错误;D、根据C=1000ρw%/M,得溶液的密度ρ=cM/1000×w%,错误。
,错误;C、w%= VM/22.4/( VM/22.4+m)=MV/(MV+22.4m),错误;D、根据C=1000ρw%/M,得溶液的密度ρ=cM/1000×w%,错误。
故选:A.
本题难度:一般
3、选择题 欲配制1.00 mol/L的NaCl溶液1000 mL,需要使用的仪器和药品是
[? ]
A.500 mL容量瓶,58.5 gNaCl
B.500 mL容量瓶,117 g NaCl
C.1 000 mL容量瓶,58.5 g NaCl
D.1 000 mL容晕瓶,117 g NaC1
参考答案:C
本题解析:
本题难度:简单
4、计算题 已知Mg能在CO2气体中燃烧(CO2+2Mg  ?2MgO+C)。若将6 g镁粉在下列不同条件下点燃。
?2MgO+C)。若将6 g镁粉在下列不同条件下点燃。
求:(1)在足量CO2气体中,反应结束后所得固体的质量。
(2)在CO2和O2的混合气体中,反应后O2有剩余,则最终固体的质量为_______克。
参考答案:(1)11.5 g(2) 10
本题解析:(1)Mg和CO2反应的化学方程式为:CO2 + 2Mg  ?2MgO + C?n(Mg)="6" g /24 g·mol-1="0.25" mol ,m(MgO)="0.25" mol×40 g·mol-1="10" g;m(C)="0.25" mol /2×12 g·mol-1="1.5" g 所以固体总质量为:10 g +1.5 g ="11.5" g?(2)活动性O2> CO2。若反应后O2有剩余,说明只发生了反应:O2 + 2Mg
?2MgO + C?n(Mg)="6" g /24 g·mol-1="0.25" mol ,m(MgO)="0.25" mol×40 g·mol-1="10" g;m(C)="0.25" mol /2×12 g·mol-1="1.5" g 所以固体总质量为:10 g +1.5 g ="11.5" g?(2)活动性O2> CO2。若反应后O2有剩余,说明只发生了反应:O2 + 2Mg  ?2MgO。n(Mg)="6" g /24 g·mol-1="0.25" mol ,m(MgO)="0.25" mol×40 g·mol-1="10" g。
?2MgO。n(Mg)="6" g /24 g·mol-1="0.25" mol ,m(MgO)="0.25" mol×40 g·mol-1="10" g。
本题难度:一般
5、选择题 每摩尔物质含有
A.6.02×1023个分子
B.6.02×1023个原子
C.阿伏加德罗常数个原子
D.阿伏加德罗常数个该物质的粒子
参考答案:D
本题解析:每摩尔的定义为:含有阿伏加德罗常数个该物质的粒子为1mol
本题难度:一般