1、填空题 (15分)已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中,都有两个未成对的电子,C、D同主族。 E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
⑴基态D原子中,电子占据的最高能层符号?,该能层具有的原子轨道数为?;
⑵E2+离子的价层电子排布图是?,F原子的电子排布式是?;
⑶A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为?,? B元素的气态氢化物的VSEPR模型为?;
⑷化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为?;
⑸配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为?;
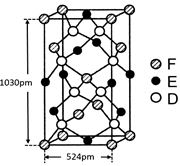
⑹某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为?,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:
d=?g/cm3。
2、填空题 已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol)
| I1
| I2
| I3
| I4
|
A
| 932
| 1821
| 15390
| 21771
|
B
| 738
| 1451
| 7733
| 10540
|

(1)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了?。
(2)ACl2分子中A的杂化类型为?。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145-140pm,有同学据此认为C60的熔点高于金刚石,你认为此观点是否正确?(填“正确”或“不正确”),并阐述作出判断的理由:?。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式?,该物质中K原子和C60分子的个数比为?。

(5)C、Si、N原子电负性由大到小的顺序是?,NCl3分子的VSEPR模型为?。
3、选择题 X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g ? L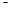 1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是(? )
1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是(? )
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由Y、Z、M三种元素形成的化合物一定只有共价键
4、选择题 稀土是工业味精,邓小平说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是(?)
A.已知Ce原子序数是58,则其为镧系元素
B.铈有四种稳定的核素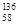 Ce、
Ce、 Ce、
Ce、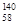 Ce、
Ce、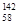 Ce,它们互为同位素
Ce,它们互为同位素
C.用Ce(SO4)2溶液可与硫酸亚铁溶液反应,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
5、选择题 几种短周期元素的原子半径及主要化合价见下表:
元素符号
| X
| Y
| Z
| R
| T
|
原子半径(nm)
| 0.130
| 0.090
| 0.102
| 0.118
| 0.073
|
主要化合价
| +2
| +2
| -2,+4,+6
| +3
| -2
|
?
根据表中信息,判断以下说法正确的是
A.单质与稀硫酸反应的速率快慢:R>Y>X
B.离子半径:T2->X2+
C.元素最高价氧化物对应水化物的碱性:Y>R>X
D.单质与氢气化合的容易程度:Z>T