1、选择题 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+ 与M2—具有相同的电子层结构;离子半径:Z2—>W—;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是(?)
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
参考答案:D
本题解析:由Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,可知Y是Si;其中X、Y、Z、W同周期,离子半径:Z2—>W—可知Z为S,W为Cl;X+ 与M2—具有相同的电子层结构,可知X为Na,M为O。A、二者可形成Na2O2,错误;B、H2O分子间能形成氢键,H2O的沸点最高,错误;C、Si为原子晶体,S和Cl2属于分子晶体,错误。 D、O3和Cl2可作为水处理中的消毒剂,正确。
本题难度:一般
2、填空题 CaC2可用于固氮:CaC2+N2 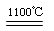 CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:??。
(2)C、N、O三种元素的第一电离能由小到大的顺序是?。
(3)NH3中N原子的杂化方式为??;根据价层电子对互斥理论推测CO32-的空间构型为?。
(4)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有??(填写一种化学式即可);写出CaCN2水解反应的化学方程式??。
参考答案:(1)1s22s22p63s23p63d104s2或[Ar]3d104s2(2)C O N(3)sp3?平面正三角形
(4)CO2或N2O?CaCN2 +3H2O=CaCO3+2NH3↑
本题解析:(1)Ca位于第四周期、最外层电子数为2,最外层电子数为2、内层排满电子的第四周期元素原子是Zn,电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2。(2)同周期元素从左向右,第一电离能总体趋势增大,但IIA和VA反常,第一电离能:N>O>C。(3)NH3中N形成3个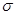 键,还有1对孤对电子,N杂化类型为sp3。CO32-中C价层电子对数=
键,还有1对孤对电子,N杂化类型为sp3。CO32-中C价层电子对数= 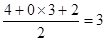 ,C与3个O成键,空间构型为平面三角形。(4)等电子体原子数相同、价电子数相同。C2-与O原子数相等,所以与CN22-互为等电子体的分子有N2O,N2与CO互为等电子体,与N2O互为等电子体的分子有CO2、BeCl2等。CaCN2与水生成NH3,同时生成CaCO3。
,C与3个O成键,空间构型为平面三角形。(4)等电子体原子数相同、价电子数相同。C2-与O原子数相等,所以与CN22-互为等电子体的分子有N2O,N2与CO互为等电子体,与N2O互为等电子体的分子有CO2、BeCl2等。CaCN2与水生成NH3,同时生成CaCO3。
本题难度:一般
3、选择题 月球的土壤中吸附着数百万吨的23He,每百吨23He核聚变所释放出的能量相当于目前人类一年多所消耗的能量。这提供了解决能源危机的新途径,在地球上,氦元素主要以24He的形式存在。下列说法中正确的是( )
A.24He原子核内含有4个质子
B.23He和24He互为同位素
C.23He原子核内含有3个中子
D.24He的最外层电子数为2,所以24He具有较强金属性
参考答案:B
本题解析:略
本题难度:一般
4、选择题 已知分子E和分子G反应,生成两种分子L和M(组成E、G、L、M分子的元素原子序数小于10 “○”代表原子“—”表示化学键),如下图,则下列判断错误的是(未配平)
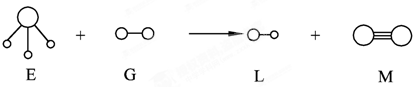
A.G是最活泼的非金属单质
B.L中的化学键是极性键
C.E能使紫色的石蕊试液变蓝
D.M的化学性质活泼
参考答案:D
本题解析:由图,得:E为三角锥结构,故为氨分子;G、L均为双原子分子;M中两原子间形成三键,故M为氮分子;说明是氨气被氧化成氮气,所以反应为:NH3+F2→HF+N2(未配平);
F原子得电子能力最强,则元素的非金属性最强,A正确;
HF中不同原子间形成极性共价键,故B正确;
氨气溶于水生成一水合氨,能电离出OH-,显碱性,则能使紫色的石蕊试液变蓝,C正确;
氮分子中存在氮、氮三键,作用力较大,故氮分子的化学性质应比较稳定,故D错误;
本题难度:一般
5、选择题 某主族元素R的最高正化合价与最低负化合价代数和为6,下列叙述正确的是:
A.R一定是第VIIA族元素
B.R的最高价氧化物为RO3
C.R的气态氢化物能燃烧
D.R的气态氢化物易溶于水显碱性
参考答案:A
本题解析:根据最高正化合价与最低负化合价的绝对值之和为8,可以知道该主族元素R一定是第VIIA族元素,所以答案为A;R的最高价氧化物为R2O7,R的气态氢化物不能燃烧;R的气态氢化物易溶于水显酸性。
点评:本题考查了元素周期表,属于高考常考的考点,该题就要知道最高正化合价与最低负化合价的绝对值之和为8,既可以选择出正确的答案。
本题难度:简单