1、选择题 右图为短周期的一部分,推断关于Y、Z、M的说法正确的是?(?)
参考答案:B
本题解析:为短周期的一部分,有三行的且X为右上角,说明X是氦,所以Y是F,M是Cl,Z是S。由此可知非金属性Y>M>Z,所以A错误;ZM2也就是SCl2,满足最外层8e-的稳定结
构,所以B正确;原子半径S>Cl>F,所以C错误;F离子的结构示意图是+92 8
本题难度:一般
2、选择题 某些花岗岩会产生氡(22286Rn)对人体产生伤害,下列关于22286Rn的叙述中错误的是 (? )
A.质子数是86
B.电子数是86
C.质量数是222
D.中子数是222
参考答案:D
本题解析:考查原子的组成及表示方法。在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,核外电子数等于质子数,所以选项D是错误的,中子数应是222-86=136。答案选D。
本题难度:简单
3、选择题 现有5种微粒,它们分别是 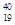 X、
X、 Y、
Y、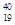 Z+、
Z+、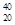 R2+、
R2+、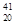 M,则它们所属的元素种类有(? )
M,则它们所属的元素种类有(? )
A.1种
B.2种
C.3种
D.4种
参考答案:C
本题解析:1940X、1940Q+的质子数相同,所以是同一元素,只是1940X是原子,1940Q+是离子;
2040R2+、2041M的质子数相同,所以是同一元素,2041M是原子,2040R2+是离子;
1840Z是质子数为18的元素;
所以共有3种元素。
故选C。
点评:本题考查了元素的定义,难度不大,注意元素概念的外延和内涵,由原子变成离子,变化的是核外电子数,不变的是核内质子数。
本题难度:简单
4、填空题 (15分)Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn?
③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+ 的核外电子排布式是??。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的?形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是?。
a.稳定性:甲>乙,沸点:甲>乙? b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙? d.稳定性:甲<乙,沸点:甲>乙
(4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为?(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为??。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于??。
参考答案: (1)1s22s22p63s23p63d9?(3分) (2)孤对电子(孤电子对)?(3分)
(1)1s22s22p63s23p63d9?(3分) (2)孤对电子(孤电子对)?(3分)
(3)b?(3分)(4)Si < C <N?(2分)
(5) 3:2?(2分)(6)原子晶体?(2分)
本题解析:根据元素的性质和结构可知,Q、R、X、Y、Z五种元素分别是C、N、O、Si、Cu。
(1)根据构造原理可知,铜离子的核外电子排布式是1s22s22p63s23p63d9。
(2)氨气是配体,提供孤对电子,铜离子提供空轨道,形成配位键。
(3)非金属性越强,相应氢化物的稳定性越强。碳的非金属性强于硅的,所以甲烷的稳定性强于SiH4的。两种氢化物形成的晶体都是分子晶体,沸点大小和分子间作用力有关系。SiH4的相对分子质量大于甲烷的,所以沸点高于甲烷的,答案选b。
(4)非金属性越强,第一电离能越大,所以第一电离能大小顺序是Si < C <N 。
(5)相对分子质量是26的是乙炔,分子中含有碳碳三键,单键都是σ键,三键是由1个σ键与2个π键构成的,所以分子中σ键与π键的键数之比3:2。
(6)电负性最大与最小的两种非金属元素分别是O个Si,形成的氧化物二氧化硅,属于原子晶体。
本题难度:一般
5、选择题 下列比较正确的是
A.原子半径: Cl > S
B.碱性:Mg(OH)2>Ca(OH)2
C.稳定性:PH3 > AsH3
D.沸点:HCl>HF
参考答案:C
本题解析:略
本题难度:一般