1、简答题 A、B、C、D、E是除稀有气体以外的5种短周期元素,原子序数依次增大并分占三个周期.B、C、D为同一周期依次相邻的3种元素,B和D的原子序数之比为3:4,E原子的电子层数等于最外层电子数.请回答相关问题:
(1)B元素在周期表中的位置______,C元素是______(填元素符号)
(2)比较D和E简单离子半径的大小(用离子符号表示):______
(3)A和D形成的含18电子化合物的化学式为______
(4)元素E形成的简单离子的水溶液与C的氢化物的水溶液反应的离子方程式为:______
(5)2007年7月2日,美、德两国科学家成功合成了具有独特化学特性的E2A6化合物,该物质在D2中能燃烧,写出它在D2中完全燃烧的化学方程式:
______.
参考答案:A、B、C、D、E是除稀有气体以外的5种短周期元素,原子序数依次增大并分占三个周期,E原子的电子层数等于最外层电子数,则E为第三周期第ⅢA族元素,即E为Al;
则B、C、D在第二周期,A在第一周期,则A为H元素;B和D的原子序数之比为3:4,B的原子序数为6,B为C元素,D的原子序数为8,D为O元素,然后可知C为N元素,
(1)由上述推断可知,B为C,C为N,B位于第二周期第IVA族,故答案为:第二周期第IVA族;N;?
(2)O、Al的离子具有相同的电子层结构,原子序数大的离子半径小,则离子半径为O2->Al3+,故答案为:O2->Al3+;?
(3)A和D形成的含18电子化合物为H2O2,故答案为:H2O2;
(4)元素E形成的简单离子的水溶液中含有Al3+,C的氢化物的水溶液为氨水,二者的离子反应
为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
(5)E2A6化合物为Al2H6,在氧气中燃耗生成氧化铝和水,则化学反应为Al2H6+3O2?点燃?.?Al2O3+3H20,
故答案为:Al2H6+3O2?点燃?.?Al2O3+3H20.
本题解析:
本题难度:一般
2、选择题 在周期表主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20.下列判断中,正确的是( )
A.原子半径:丙>乙>甲>丁
B.气态氢化物的稳定性:甲>丙
C.最高价氧化物对应水化物的酸性:丁>甲
D.乙和甲或乙和丁所能形成的化合物都是有毒物质
参考答案:B
本题解析:
本题难度:简单
3、选择题 X、Y、Z都是短周期元素,X原子的最外层只有1个电子,Y原子的M层电子数只有K层与L层电子数之和的一半,Z原子的L层电子数比Y原子的L层电子数少2,且Y元素可有2种正价,两种正价的差值为2。由X、Y、Z三种元素组成的化合物的化学式可能是
[?]
①X2YZ3 ②XYZ3 ③XYZ4 ④X2YZ4 ⑤X3YZ3 ⑥X3YZ4
A.①②③?
B.④⑤⑥
C.②⑤⑥?
D.①③⑤
参考答案:C
本题解析:
本题难度:简单
4、填空题 X、Y、Z是中学化学常见的三种元素,其中,X、Z位于短周期.常温下,X单质为黄绿色气体;向含Y离子的溶液中滴加氢氧化钠溶液,生成白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;Z的最外层电子数与核外电子总数之比为3:13.请回答下列问题:
(1)Z在元素周期表中的位置是______,X单质分子的电子式是______.
(2)Z单质与Y的氧化物在高温条件下反应是冶炼Y单质的一种方法,该反应化学方程式是______.
(3)含上述元素的某些物质常用于处理工业废水,部分流程如图1:
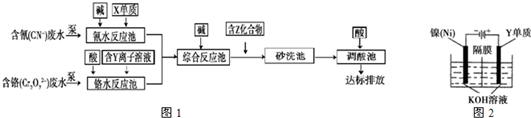
①处理含铬废水时,在反应池中Cr2O72-变为Cr3+,当反应转移1mol?电子时,有______?mol?Cr2O72-?转化(计算结果保留两位小数).
②含Z化合物可以使水中悬浮颗粒发生凝聚,原因是______(用文字和化学用语表示).
③处理含氰废水时,CN-最终转化为两种无毒的气体,该反应的离子方程式是______.
(4)利用图2方法电解可得到一种新型净水剂K2YO4,阳极的电极反应式为______.
参考答案:常温下,X单质为黄绿色气体应为Cl2,则X为Cl元素,向含Y离子的溶液中滴加氢氧化钠溶液,生成白色絮状沉淀,迅速变为灰绿色,最后变为红褐色,该红色沉淀为Fe(OH)3,则Y为Fe元素,Z的最外层电子数与核外电子总数之比为3:13,应为Al元素,
(1)Z为Al元素,原子核外有3个电子层,最外层电子数为3,则应位于周期表三周期ⅢA族,X单质为Cl2,电子式为

,
故答案为:三周期ⅢA族,

;
(2)Z单质与Y的氧化物在高温条件下反应是冶炼Y单质,为Al和铁的氧化物的反应,为铝热反应,反应的可能方程式为Fe2O3+2Al?高温?.?Al2O3+3Fe或3Fe3O4+8Al?高温?.?4Al2O3+9Fe或3FeO+2Al?高温?.?Al2O3+3Fe,
故答案为:Fe2O3+2Al?高温?.?Al2O3+3Fe或3Fe3O4+8Al?高温?.?4Al2O3+9Fe或3FeO+2Al?高温?.?Al2O3+3Fe;
(3)①Cr2O72-变为Cr3+,化合价由+6价降低到+3价,当有1mol电子转移时,应有13molCr被还原,则有16molCr2O72-被还原,即0.17mol,
故答案为:0.17;
②铝离子易水解产生氢氧化铝,反应的离子方程式为Al3++3H2O

Al(OH)3+3H+,氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来,
故答案为:Al3++3H2O

Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来;
③两种无毒的气体为二氧化碳和氢气,而反应物为CN-和Cl2,则反应氧化还原反应,反应的离子方程式为2CN-+5Cl2+8OH-=2CO2+N2+H2O+10Cl-,
故答案为:2CN-+5Cl2+8OH-=2CO2+N2+H2O+10Cl-;
(4)阳极发生氧化反应,Fe被氧化为FeO42-,电极反应式为Fe-6e-+8OH-=FeO42-+4H2O,
故答案为:Fe-6e-+8OH-=FeO42-+4H2O.
本题解析:
本题难度:一般
5、选择题 某基态原子的电子排布式为1s22s22p63s23p63d54s2,下列说法中不正确的是
[? ]
A.该元素基态原子中共有25个电子
B.该元素原子核外有4个电子层
C.该元素原子最外层共有2个电子
D.该元素原子M电子层共有8个电子
参考答案:D
本题解析:
本题难度:简单