1、选择题 X元素的阳离子与Y元素的阴离子具有相同的电子层结构,下列叙述正确的是( )
A.原子序数X<Y
B.原子半径X<Y
C.离子半径X>Y
D.原子最外层电子数X<Y
参考答案:D
本题解析:
本题难度:一般
2、简答题 同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列).该周期部分元素氟化物的熔点见下表.
| 氟化物 | AF | BF2 | DF4
熔点/K
1266
1534
183
|
(1)A原子核外共有______种不同运动状态的电子、______种不同能级的电子;
(2)元素C的最高价氧化物对应水化物的电离方程式为______;
(3)解释上表中氟化物熔点差异的原因:______;
(4)在E、G、H三种元素形成的氢化物中,热稳定性最大的是______(填化学式).A、B、C三种原子形成的简单离子的半径由大到小的顺序为______(填离子符号).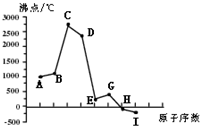
参考答案:图中曲线表示8种元素的原子序数(按递增顺序连续排列)和单质沸点的关系,H、I的沸点低于0℃,根据气体的沸点都低于0℃,可推断H、I为气体,气体元素单质为非气体,故为第三周期元素,则A为Na,B为Mg,C为Al,D为Si,E为P、G为S,H为Cl,I为Ar,
(1)A为Na元素,原子核外电子数为11,故共有11种不同运动状态的电子,原子核外电子排布式为1s22s22p63s1,有4种不同能级的电子,
故答案为:11;4;
(2)氢氧化铝为两性氢氧化物,电离方程式为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-,
故答案为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-;
(3)NaF与?MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,故MgF2的熔点比NaF高,
故答案为:NaF与?MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,故MgF2的熔点比NaF高;
(4)同周期自左而右非金属性增强,非金属性Cl>S>P,非金属性越强氢化物越稳定,故HCl最稳定性,
Na+、Mg2+、Al3+电子层结构相同,电子层结构相同核电荷数越大离子半径越小,故离子半径Na+>Mg2+>Al3+,
故答案为:HCl;Na+>Mg2+>Al3+.
本题解析:
本题难度:一般
3、选择题 根据下表中部分短周期元素的原子半径及主要化合价判断,下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T
原子半径/nm
0.160
0.143
0.075
0.102
0.074
主要化合价
+2
+3
+5、+3
+6、-2
-2
|
A.离子半径:L2+>T2-
B.氢化物的还原性:H2T>H2R
C.M与T形成的化合物只能与盐酸反应,不与NaOH溶液反应
D.一定条件下,T的单质可将Q从其氢化物中置换出来
参考答案:短周期元素R、T都有-2价,应位于周期表第ⅥA族,其中R有+6价,则T为O元素,R为S元素,Q比T的原子半径略大,最高化合价为+5价,应为N元素,L的化合价为+2价,由原子半径可确定L为Mg,M的最高正价为+3价,由原子半径关系可确定M为Al,
A.L2+与T2-具有相同的核外电子排布,核电荷数越大,离子半径越小,故A错误;
B.非金属性O>S,非金属性越强,对应的氢化物的还原性越弱,故B错误;
C.M与T形成的化合物为Al2O3,具有两性,既可与酸反应,也可与碱反应,故C错误;
D.由于O的非金属性比N强,则一定条件下,O的单质可将N从其氢化物中置换出来,故D正确.
故选D.
本题解析:
本题难度:简单
4、选择题 某基态原子的电子排布式为1s22s22p63s23p63d54s2,下列说法中不正确的是
[? ]
A.该元素基态原子中共有25个电子
B.该元素原子核外有4个电子层
C.该元素原子最外层共有2个电子
D.该元素原子M电子层共有8个电子
参考答案:D
本题解析:
本题难度:简单
5、简答题 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子.
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)A~F六种元素原子,原子半径最大的是______(填序号).
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为:______.
(3)B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是:______.
(4)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为______.
参考答案:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,化合物为水,则A为H元素,C为O元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为5,则B为N元素;A、D同主族,则D为Na元素;C与E同主族,则E为S元素;D、E、F同周期,A能分别与E、F形成电子总数相等的气体分子,则F为Cl元素,即A为H元素,B为N元素;C为O元素,D为Na元素;E为S元素;F为Cl元素.
(1)同周期随原子序数增大,原子半径减小,最外层电子数相同,电子层越多原子半径越大,所以Na原子半径最大,故答案为:D;
(2)A为H元素,C为O元素,D为Na元素,三元素形成的常见化合物为NaOH,属于离子化合物,由钠离子与氢氧根离子构成,电子式为

,
故答案为:

;
(3)B为N元素;F为Cl元素.两种元素形成的一种化合物分子,各原子均达八电子结构,该化合物是NCl3,其中N显负价,Cl显正价,其水解的主要产物为HClO和NH3(NH3?H2O).
故答案为:HClO和NH3(NH3?H2O);
(4)A为H元素,C为O元素,E为S元素;三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该化合物为H2SO4,该反应的化学方程式为Cu+2H2SO4(浓)?△?.?CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)?△?.?CuSO4+SO2↑+2H2O.
本题解析:
本题难度:一般