|
高考化学知识点总结《物质的量》考点巩固(2019年最新版)(六)
2020-08-13 06:37:33
【 大 中 小】
|
1、选择题 在2 L溶有0.2mol NaCl和0.2mol MgCl2的溶液中,Cl—的物质的量浓度为
A.0.05 mol/L
B.0.1 mol/L
C.0.2 mol/L
D.0.3 mol/L
|
参考答案:D
本题解析:溶液中Cl-物质的量为0.2 mol +0.2 mol×2=0.6mol,Cl-物质的量浓度为0.3mol/L。
考点:化学计算
点评:c=n/V,其中n可以代表溶质的物质的量,也可以代表离子的物质的量,V表示溶液的体积。
本题难度:一般
2、填空题 有五种物质是①6 g H2②0.5 mol CO2③1.204×10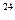 个氯化氢分子④147 g硫酸 个氯化氢分子④147 g硫酸
⑤92 g乙醇(C2H5OH),它们的物质的量最大的是?,所含分子数最多的是?,含有原子个数最多的是?,质量最大的是?。
参考答案:①?①?⑤?④
本题解析:首先“见量化摩”,以物质的量为核心再进行转换。
①n(H2)="3" mol
②n(CO2)="0.5" mol
③n(HCl)="2" mol
④n(H2SO4)="1.5" mol
⑤n(C2H5OH)="2" mol
所以物质的量最大的是①。因物质的量越大,所含分子数越多,所以所含分子数最多的也是①。
①~⑤含原子的物质的量分别为6 mol、1.5 mol、4 mol、10.5 mol、18 mol,故含原子个数最多的是⑤。
经计算可知质量最大的是④。
本题难度:简单
3、选择题 有体积相同的碳酸钠溶液和盐酸。①将碳酸钠溶液逐滴加入盐酸中与②盐酸逐滴加入碳酸钠溶液中产生的气体物质的量之比为2 :1,则原碳酸钠溶液和盐酸中溶质的物质的量之比为?(?)
A.2:1
B.1:1
C.3:4
D.1:2
参考答案:C。
本题解析:假设①②产生的气体的物质的量分别为2mol、1mol ,因两种操作中盐酸不可能均过量(生成的CO2量不同),故盐酸为不足量。
①将碳酸钠溶液逐滴加入盐酸,由反应Na2CO3+2HCl=2NaCl+H2O+CO2↑知消耗n(HCl)=4mol,
②盐酸逐滴加入碳酸钠中反应分步进行(盐酸完全反应,NaHCO3有剩余),由方程式NaHCO3 + HCl =" NaCl" + H2O + CO2↑,Na2CO3 + HCl = NaHCO3及n(CO2)=1mol可求得n(Na2CO3)=3mol,故此反应中原碳酸钠溶液和盐酸中溶质的物质的量之比为3:4。
本题难度:一般
4、选择题 跟100mL?0.1mol/L(NH4)2SO4溶液中的NH4+浓度相同的是( )
A.0.1mol/LNH4NO3溶液100mL
B.0.2mol/L氨水溶液100mL
C.0.2mol/LNH4Cl溶液200mL
D.0.2mol/L(NH4)2SO3溶液50mL
参考答案:A、0.1mol/LNH4NO3溶液c(NH4+)=0.1mol/L,不相等,故A错误;
B、氨水为弱电解质,0.2mol/L氨水溶液中c(NH4+)<0.2mol/L,不相等,故B错误;
C、0.2mol/LNH4Cl溶液c(NH4+)=c(NH4Cl)=0.2mol/L,故C正确;
D、0.2mol/L(NH4)2SO3溶液c(NH4+)=2c((NH4)2SO4)=2×0.2mol/L=0.4mol/L,不相等,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 设阿伏加德罗常数为NA,下列叙述中正确的是
A.1 mol 18O2所含质子数为16NA
B.10 g氖气所含原子数为0.5NA
C.0.5 mol Al和足量烧碱反应转移的电子数为1.5NA
D.标准状况下11.2 L SO3所含分子数为0.5NA
参考答案:AC
本题解析:18O为8质子10中子原子,故1 mol 18O2所含质子数为16 mol,即16NA;10 g Ne为1 mol,故其原子数应为NA;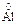 在与NaOH充分反应后转化为Na 在与NaOH充分反应后转化为Na O2,即1 mol Al可失去3 mol电子,故0.5 mol Al可失去的电子数为1.5NA;在标准状况下SO3为固体,11.2 L SO3的物质的量远大于0.5 mol。 O2,即1 mol Al可失去3 mol电子,故0.5 mol Al可失去的电子数为1.5NA;在标准状况下SO3为固体,11.2 L SO3的物质的量远大于0.5 mol。
本题难度:一般
|