1、选择题 将1 mol CO和2 mol H2充入一容积为1 L的密闭容器中,分别在250℃、T℃下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH=a kJ/mol,如图所示。下列分析中正确的是( )
CH3OH(g) ΔH=a kJ/mol,如图所示。下列分析中正确的是( )

A.250℃时,0~10 min H2反应速率为0.015 mol/(L·min)
B.平衡时CO的转化率:T℃时小于250℃时
C.其他条件不变,若减小容器体积,CO体积分数增大
D.a<0,平衡常数K:T℃时大于250℃
参考答案:D
本题解析:A项,甲醇的物质的量增加0.15 mol,则H2减小0.3 mol,v(H2)=0.03 mol/(L·min);B项,T℃达到平衡时甲醇物质的量大,则CO的转化率大;C项,减小体积相当于增大压强,平衡向正反应方向移动,CO的体积分数减小;D项,a<0即正反应放热,降温平衡向正反应方向移动,K值增大。
点拨:本题考查化学平衡,考查考生根据图像解题的能力。难度较大。
本题难度:一般
2、选择题 下列关于化学反应速率的说法中正确的是(? )
A.决定化学反应速率的主要因素是温度
B.反应速率用于衡量化学反应进行快慢
C.可逆反应达到平衡状态时正逆反应的速率都为0
D.增大反应物的量或提高反应温度一定能增大反应速率
参考答案:B
本题解析:A、决定化学反应速率的主要因素是反应物的性质,错误;B、反应速率用于衡量化学反应进行快慢,这是反应速率的意义,正确;C、可逆反应达到平衡状态时正逆反应的速率相等,但不为0,错误;D、增大反应物的量不一定能增大反应速率,如反应物是固体时,增大反应物的量对反应速率无影响,错误,答案选B。
本题难度:一般
3、选择题 100mL6mol/L的H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成H2的总量,可向反应物中加入适量 (? )
A.Na2CO3(s)
B.水
C.Na2SO4(s)
D.(NH4)2SO4(s)
参考答案:B
本题解析:略
本题难度:简单
4、选择题 将气体A、B置于容积为2L的密闭容器中,发生如下反应:4A(g)+B(g) 2C(g)。反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol。用生成物C浓度的增大来表示该反应的速率为
2C(g)。反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol。用生成物C浓度的增大来表示该反应的速率为
A.0.025mol·L-1·s-1? B.0.0125mol·L-1·s-1?
C.0.05mol·L-1·s-1? D.0.1mol·L-1·s-1
参考答案:A
本题解析:反应速率通常用单位时间内浓度的变化量来表示,所以C物质的反应速率是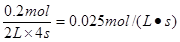 ,答案选A。
,答案选A。
本题难度:简单
5、选择题 在2L密闭容器内,一定条件下发生A+3B?2C反应,在10s内,反应物A的浓度由2mol/L降到1.2mol/L,则C的反应速率为( )
A.1.6mol/(L?s)
B.0.08mol/(L?s)
C.0.16mol/(L?s)
D.0.8mol/(L?s)
参考答案:10s内,反应物A的浓度由2mol/L降到1.2mol/L,
所以v(A)=2mol/L-1.2mol/L10s=0.08mol/(L?s).
速率之比等于化学计量数之比,所以v(C)=2v(A)=2×0.08mol/(L?s)=0.16mol/(L?s).
故选C.
本题解析:
本题难度:简单