1、填空题 (10分)在一个固定体积为2升的密闭容器中,充入2 mol A和1 mol B,发生如下反应:2A(g) + B(g) ?3C(g) +
?3C(g) + D(s),2分钟反应达到平衡,此时C的浓度为1.2mol·L-1。
D(s),2分钟反应达到平衡,此时C的浓度为1.2mol·L-1。
(1)写出该反应平衡常数的表达式?,
2分钟内B 的平均反应速度为?
(2)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,
则正反应为?(填“吸热”或“放热”)反应。
(3)若将容器体积缩小至1L,反应达到平衡时C的浓度为?mol·L-1,
平衡常数?(填“增大”、“减小”或“不变”)。
2、简答题 将等物质的量的A、B混合于2L的密闭容器中发生反应3A(g)+B(g)═xC(g)+2D(g),经5min后,测得D的浓度为0.5mol?L-1,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L?min).则:
(1)此时,A的物质的量浓度为______;
(2)反应开始前容器中A、B的物质的量为______;
(3)B的平均反应速率为______;
(4)x的值为______.
3、选择题 右图表示可逆反应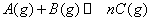
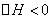 ,在不同条件下反应混合物中C的质量分数C%和反应过程所需时间的关系曲线,有关叙述一定正确的是
,在不同条件下反应混合物中C的质量分数C%和反应过程所需时间的关系曲线,有关叙述一定正确的是

A.a表示有催化剂,而b无催化剂
B.若其他条件相同,a比b的温度高
C.若其他条件相同,a比b的压强大,n=l
D.反应由逆反应方向开始
4、选择题 下列事实不能用勒夏特列原理解释的是(?)
A.配制FeSO4溶液时在溶液中加入稀硫酸
B.温度控制在450℃有利于二氧化硫的催化氧化
C.增大压强有利于合成氨反应
D.工业制取金属钾Na(l)+ KCl(l)  NaCl(l)+K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来
5、填空题 (12分)在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g);△H=" Q" KJ/mol其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g);△H=" Q" KJ/mol其化学平衡常数K和温度t的关系如下:
t℃
| 700
| 800
| 850
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
请回答:
(1)上述反应中Q?0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是?。
a. 容器中压强不变? b. 反应热不变? c. v正(H2) =v逆(CO)? d. CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
850℃时物质的浓度(mol/L)的变化
时间(min)
| CO
| H2O
| CO2
| H2
|
0
| 0.200
| 0.300
| 0
| 0
|
2
| 0.138
| 0.238
| 0.062
| 0.062
|
3
| c1
| c 2
| c 3
| c 3
|
4
| c 1
| c 2
| c 3
| c 3
|
5
| 0.116
| 0.216
| 0.084
| ?
|
6
| 0.096
| 0.266
| 0.104
| ?
|
①计算:3 min时CO的浓度c 1 =?mol/L,H2O (g)的转化率=?。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是?表中5min~6min之间数值发生变化,可能的原因是?
a . 增加水蒸气? b. 降低温度? c. 使用催化剂? d. 增加氢气浓度