1、选择题 T℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)?△H="-49.0" kJ/mol
CH3OH(g)+H2O(g)?△H="-49.0" kJ/mol
测得H2和CH3OH(g)的浓度随时间变化情况如下图所示。下列说法不正确的是
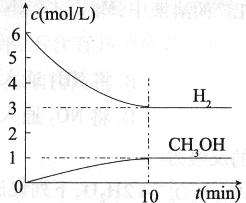
A.0~10 min内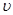 (H2)="0.3" mol/(L·min)
(H2)="0.3" mol/(L·min)
B.T℃时,平衡常数K=1/27,CO2与H2的转化率相等
C.T℃时,反应中当有32 g CH3OH生成时,放出49.0 kJ的热量
D.达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率
2、选择题 一定温度下,在体积为 VL 的密闭容器中加入1molX和1molY进行如下反应:
X(g) + Y(g ) 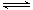 2Z(g )+ W(s) ;△H >0达到平衡,下列判断正确的是(?)
2Z(g )+ W(s) ;△H >0达到平衡,下列判断正确的是(?)
A.向平衡混合物中加入少量W,正、逆反应速率均增大
B.平衡后加入X,上述反应的△H增大
C.温度不变,将容器的体积变为2VL,Z的平衡浓度变为原来的1/2
D.当容器中混合气体的压强不变时,可以证明此反应已达到平衡状态
3、选择题 大气中的SO2是造成酸雨的主要污染物。最新研究表明,[N(CH3)4]2SO4(s)能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂[N(CH3)4]2SO4(s)+ SO2 [N(CH3)4]2S2O6(s)ΔH<0?则用[N(CH3)4]2SO4(s)吸收SO2的适宜条件为
[N(CH3)4]2S2O6(s)ΔH<0?则用[N(CH3)4]2SO4(s)吸收SO2的适宜条件为
A.高温高压
B.低温高压
C.高温低压
D.低温低压
4、填空题 (16分)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3(s)+3 H2(g)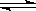 W(s)+3 H2O(g)
W(s)+3 H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为?
(2)某温度下反应达平衡时,随温度的升高, H2与水蒸气的体积比减小,则该反应为_____________反应(填 吸热或放热)
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
温度
| ?25 ℃? ~? 550 ℃? ~? 600℃? ~? 700℃
|
主要成分
| ?WO3?W2O5?WO2?W
|
第一阶段反应的化学方程式为___________________________________________;580℃时,固体物质的主要成分为______? _________;,
(4)已知:温度过高时,WO2(s)转变为WO2(g);
WO2(s)+2 H2(g)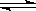 W(s)+2H2O(g)?ΔH=+66 kJ·mol-1
W(s)+2H2O(g)?ΔH=+66 kJ·mol-1
WO2(g)+2 H2(g)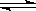 W(s)+2H2O(g)?ΔH= —137.9 kJ·mol-1
W(s)+2H2O(g)?ΔH= —137.9 kJ·mol-1
则WO2(s)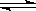 WO2(g)的ΔH=_____? _______.
WO2(g)的ΔH=_____? _______.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:

下列说法正确的有____________.
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时, WI4的分解速率加快,W和I2的化合速率减慢
5、填空题 (14分)如图的甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1 mol A、3 mol B,此时两容器体积均为500 mL,温度为T℃。保持温度不变,发生反应A(g)+3B(g) 2C(g)+D(s);△H<0。
2C(g)+D(s);△H<0。
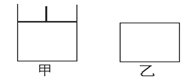
 (1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是________。
(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是________。
A.混合气体的总质量不随时间改变? B.2 v正(C)=3 v逆(B)
C.A、B转化率相等? D. 物质D的质量不随时间改变
(2)2 min后甲容器中的化学反应达到平衡, 测得C
测得C 的浓度为2 mol/L,此时容器的体积为________mL,B的转化率α甲(B)为________。
的浓度为2 mol/L,此时容器的体积为________mL,B的转化率α甲(B)为________。
(3)乙容器中反应 达到平衡所需要的时间______2 min(填“>、<或=”),B的转化率α
达到平衡所需要的时间______2 min(填“>、<或=”),B的转化率α 乙(B) ______α甲(B) (填“>、<或=”)。
乙(B) ______α甲(B) (填“>、<或=”)。
(4)若其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C)=________mol,加入D的物质的量n (D)应该满足的条件为________________________。