| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《能量的相互转化》高频考点特训(2019年练习版)(六)
  Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示 Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示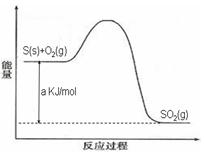 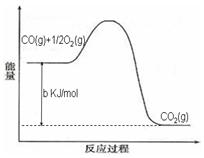 则用SO2除去CO的热化学方程式为? _____________________________________。 (3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是:2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________。 2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________。(4)利用ClO2氧化氮氧化物反应过程如下:  ? ?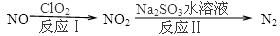 反应Ⅰ的化学方程式是2NO+ClO2+H2O═NO2+HNO3+2HCl,反应Ⅱ的离子方程式是 ________________。若有11.2L N2生成(标准状况),共消耗NO _________________ g。 (5)工业废气中含有的NO2还可用电解法消除。用NO2为原料可制新型绿色硝化剂N2O5。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备 N2O5,装置如图所示。 Pt乙为 _____极,电解池中生成N2O5的电极反应式是________________。  参考答案:(1)D (2分) 本题解析:(1)A、该反应是可逆反应,所以装有尾气净化装置的汽车排出的气体中仍然含有NO或CO,错误;B、570K时的平衡常数为1×1059,已经很高没必要提高温度,错误;C、增大压强平衡正向移动,理论上可增大净化效率,但不可取,净化装置一旦装上很难改变其压强,错误;D、该反应的平衡常数已经很高,但反应速率太慢,所以使用高效催化剂可大大提高反应速率,从而提高净化效率,正确,答案选D。 本题难度:一般 4、选择题 工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是 参考答案:A 本题解析:从原料的量、SO2的转化率为50%可知,1 mol SO2完全反应放出热量98.3 kJ,故热化学方程式为SO2(g)+ 本题难度:简单 5、选择题 化学反应中的能量变化通常表现为热量的变化,下列图示能表示Ba(OH)2·8H2O与NH4Cl的反应过程中能量变化的是 [? ] A  B  C  D  参考答案:A 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《热化学方程.. | |