1、选择题 下列说法正确的是
A.同主族元素的单质从上到下,熔点升高
B.元素的最高正化合价在数值上等于它所在的族序数
C.同周期主族元素的原子半径越小,越难失去电子
D.元素的非金属性越强,它的气态氢化物水溶液的酸性越强
参考答案:C
本题解析:
正确答案:C
A.不正确,由分子构成的同主族元素的单质从上到下,熔点升高,如:卤素的单质;
B.不正确,大多数元素的最高正化合价在数值上等于它所在的族序数,但O最高价为+2价,OF2;
C.正确,同周期主族元素的原子半径越小,对电引力越大,越难失去电子
D.不正确,元素的非金属性越强,它的最高价氧化物对应水化物水溶液的酸性越强
本题难度:简单
2、选择题 除去NaCl中混有的 MgCl2、Na2SO4时选用
A.NaOH、Ba(NO3) 2、Na2CO3、HCl
B.Ca(OH) 2、Mg(NO3) 2、Na2CO3、HCl
C.NaOH、BaCl2、Na2CO3、HCl
D.Na2CO3、BaCl2、HCl
参考答案:C
本题解析:试题分析:因为反应要在溶液中进行,所以要先配制成溶液,然后除去硫酸根离子,再除钙离子和镁离子,最后加入盐酸除去过量的碳酸根和氢氧根.
故答案为:(1)将粗盐溶于足量水中制成溶液.
(2)向上述溶液中加入足量的BaCl2溶液,除去SO42-,Na2SO4+BaCl2=BaSO4↓+2NaCl,过滤,除去滤渣.
(3)向上述虑液中加入足量的Na2CO3溶液,除去Ba2+, Na2CO3+BaCl2=BaCO3↓+2NaCl,过滤,除去滤渣.
(4)向(3)虑液中加入足量的NaOH溶液,除去Mg2+,2NaOH+MgCl2=Mg(OH)2↓+2NaCl,过滤,除去滤渣.
(5)向(4)虑液中滴加稀盐酸,调节PH=7,除去CO32-和OH-,Na2CO3+2HCl=H2O+CO2↑+2NaCl,NaOH+HCl=NaCl+H2O.
(6)将NaCl溶液蒸发,洗涤干燥,即得较纯净的食盐。
故选C。
考点:物质除杂或净化的探究 盐的化学性质
点评:除杂一般有两种方法,将杂质彻底除去或将杂质转化为主物质,所选物质不能与主物质发生反应,也不要在除去杂质的同时又混入了其它物质。要注意除杂质的顺序。
本题难度:简单
3、填空题 (12分)【化学—物质结构与性质】
石墨烯(如图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙).

(1)图甲中,1号C与相邻C形成σ键的个数为 _________ .
(2)图乙中,1号C的杂化方式是 _________ ,该C与相邻C形成的键角 _________ (填“>”“<”或“=”)图甲中1号C与相邻C形成的键角.
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有 _________ (填元素符号).
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为 _________ ,该材料的化学式为 _________ .
参考答案:(1)3
(2)sp3;<
(3)O、H
(4)12;M3C60
本题解析:(1)根据图甲可知1号C与相邻C形成σ键的个数为3.
(2)图乙1号碳形成了4个σ键,所以1号C的杂化方式为sp3;图乙1号C与相邻C形成的键角是109.5℃,图甲1号C与相邻C的键角是120℃。
(3)氧化石墨烯中O原子与H2O中的H原子,氧化石墨烯中H原子与H2O中O原子都可以形成氢键。
(4)根据切割法,晶胞含M原子的个数为:12×1/4+9=12;C60位于顶点和面心,所以晶胞含C60个数为:8×1/8+6×1/2=4,所以化学式为M3C60
本题难度:一般
4、选择题 已知A2-核内有x个中子,A原子的质量数为m,则n g A2-所含电子的总物质的量是(?)
A.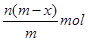
B.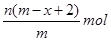
C.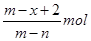
D.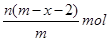
参考答案:B
本题解析:根据质量数=质子数+中子数可以得到,A2-核内有x个中子,A原子的质量数为m,所以A2-质子数为m-x,一个A2-的电子数目为m-x+2,所以n g A2-所含电子的总物质的量是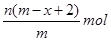 ,答案选B。
,答案选B。
本题难度:一般
5、填空题 (1)按要求填空:电负性最大的元素符号 ______;第一电离能最大的元素基态原子核外电子排布式_________;第三周期原子半径最小的元素的价电子排布式______。
(2)在下列物质中:①N2、②H2O、③NaOH、④MgCl2、⑤C2H4、⑥Na2O2(用序号填空)
其中只含有非极性键的是?;只含有极性键的是?;只含有离子键的是?;既含有非极性键又含有极性键的是?;含有非极性键的离子化合物是?。
(3)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的?键更稳定(填“σ”或“π”)。
参考答案:(9分)(1)F? 1s2? 3s23p5?(2)①;②;④;⑤;⑥?(3)π (各1分)
本题解析:(1)非金属性越强,电负性越大,所以电负性最大的是F。He最外层电子数只有2个,稳定性强,第一电离能最大,则基态原子核外电子排布式是1s2。同周期自左向右,原子半径逐渐减小,所以第三周期原子半径最小的元素是氯元素,其价电子排布式是3s23p5。
(2)一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。如果是由同一种非金属的原子之间形成共价键,是非极性键,由不同种非金属的原子之间形成共价键,是极性键,所以只含有非极性键的是氮气;只含有极性键的是水;只含有离子键的是氯化镁;既含有非极性键又含有极性键的是乙烯;含有非极性键的离子化合物是过氧化钠,氢氧化钠是含有离子键和极性键的离子化合物。
(3)氮气中的三键是由1个δ键和2个π键构成的,所以根据N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1可知,π键键能是(942kJ/mol-247kJ/mol)÷2=347.5 kJ/mol>247kJ/mol,所以π键稳定。
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。试题基础性强,侧重对学生基础知识的巩固和训练,主要是考查学生灵活运用物质结构知识解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力,提高学生的学科素养。
本题难度:一般