1、选择题 下列分子结构中,原子的最外电子都能满足8电子稳定结构的是(?)
A.XeF2
B.CO2
C.PCl5
D.HClO
2、填空题 (6分)写出下列原子的电子排布式。
(1)S (2)29Cu (3) 26Fe
(1)________________________________________________________________________
(2)________________________________________________________________________
(3)________________________________________________________________________
3、填空题 (本题共12分)
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3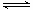 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压? b.增加NH3的浓度? c.升温? d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。
_________________________________________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
__________________________________________
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为____________________。其中氮元素原子最外层电子排布的轨道表达式是_________________________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________。CS2熔点高于CO2,其原因是__________。
4、填空题 (本题共12分)
我国钾长石(KAlSi3O8)的资源比较丰富。工业上可用食盐和钾长石在一定条件下制备氯化钾:NaCl (l) +KAlSi3O8 (s)  ?KCl (l)+NaAlSi3O8 (s)。
?KCl (l)+NaAlSi3O8 (s)。
完成下列填空:
(1)硅原子的最外层电子占据了?个轨道,有?种能量。
(2)氯化钠的熔点比氯化钾的?(填“高”或“低”),原因是?。
(3)把反应中涉及到的六种元素的原子半径按从小到大的顺序排列?。
(4)参与上述反应且位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,这种元素是?。
(5)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占全部钾元素质量的百分率)与温度的关系,进行实验(氯化钠与钾长石投料的质量比为2:1),获得如下数据:
?时间(h)
钾元素
温度?熔出率
| 1.5
| 2.5
| 3.0
| 3.5
| 4.0
|
830℃
| 0.481
| 0.575
| 0.626
| 0.669
| 0.685
|
890℃
| 0.579
| 0.691
| 0.694
| 0.699
| 0.699
|
950℃
| 0.669
| 0.714
| 0.714
| 0.714
| 0.714
|
?
①分析数据可以得出,该制备氯化钾的反应是?(填“放热”或“吸热”)反应。
②计算890℃时,氯化钠的平衡转化率?。(式量:KAlSi3O8–278? NaAlSi3O8 –262)
③950℃时,提高熔出钾的速率可以采取的措施是?(写出两种)。
5、选择题 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是
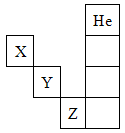
①X的气态氢化物与Y的最高价氧化物对应的水化物所生成的盐属于离子化合物
②Y、Z的气态氢化物的水溶液的酸性Y<Z
③Z的单质在常温下是液体,可与镁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有18种元素
A.①②③④
B.①②③④⑤
C.只有③⑤
D.只有①④