1、选择题 设阿伏加德较常数的数值为NA,下列说法正确的是
A.1.8g NH4+含有的电子数为NA
B.1 mol Cl2与足量Fe反应,转移的电子数为3NA
C.46g的NO2与46g的N2O4含有的原子数不同
D.标准状况下11.2L苯完全燃烧产生二氧化碳分子数为3NA
参考答案:A
本题解析:
本题难度:简单
2、选择题 某10% NaOH溶液,加热蒸发掉100 g水后得到80 mL 20%的溶液,则该20% NaOH溶液的物质的量浓度为
A.6.25 mol /L
B.12.5 mol /L
C.7 mol /L
D.7.5 mol /L
参考答案:A
本题解析:试题分析:根据质量守恒定律可知,蒸发掉100 g水后的NaOH的质量并没有改变,可以列出如下方程式,设原溶液的质量为m,可以得到m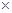 10%=(m-100)
10%=(m-100)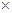 20%,解得m=200g,从而可以算出NaOH的质量为20g即0.5mol,根据
20%,解得m=200g,从而可以算出NaOH的质量为20g即0.5mol,根据
c=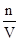 =
=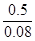 ?mol /L="6.25" mol /L?,故答案为A
?mol /L="6.25" mol /L?,故答案为A
考点:物质的量浓度的相关计算
点评:本题考查物质的量浓度的相关计算,难度不大。但解答此题的关键在于利用质量守恒定律。
本题难度:简单
3、选择题 下列物质属于电解质的是
A.Na2O
B.SO3
C.Cu
D.NaCl溶液
参考答案:A
本题解析:Na2O为离子化合物,在熔融条件下能导电,为电解质,故A正确;SO3为共价化合物,在熔融条件下不能导电,其水溶液能导电是SO3与水反应生成的H2SO4导电,故SO3为非电解质,B不正确;Cu是单质,NaCl溶液为混合物,它们既不是电解质,也不是非电解质,故C、D都不正确。
本题难度:困难
4、选择题 某氯化镁溶液的密度为1.18?g/cm3,其中镁离子的质量分数为10%,120?mL该溶液中氯离子的物质的量等于
A.0.58 mol
B.1.18 mol
C.1.00 mol
D.1.50mol
参考答案:B
本题解析:
本题难度:简单
5、选择题 在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为
A.0.1mol
B.0.5mol
C.0.15mol
D.0.25mol
参考答案:B
本题解析:
正确答案:B
解由电荷守恒:n(K+)+2n(Mg2+)= 2n(SO42―)+n(Cl― )
1.5mol+2×0.5mol=2n(SO42―)+1.5mol
n(SO42―)=0.5mol
本题难度:一般