1、选择题 下列混合物的分离或提纯方法中,主要是从物质沸点的角度考虑的是(?)?
A.用半透膜除去Fe(OH)3胶体中的NaCl
B.蒸馏法淡化海水
C.分离 豆浆和豆渣
豆浆和豆渣
D.熬煮中药
参考答案:B
本题解析:略
本题难度:简单
2、选择题 海洋约占地球表面积的71%,对其进行开发利用的部分流程如下图所示。下列说法不正确的是(? )
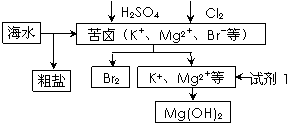
A.可用BaCl2溶液除去粗盐中的SO42-
B.从苦卤中提取Br2的反应的离子方程式为:2Br- + Cl2 ="=" 2Cl- + Br2
C.试剂1可以选用石灰乳
D.工业上,电解熔融Mg(OH)2冶炼金属镁
参考答案:D
本题解析:本题考查了物质的分离及提纯、海水资源的利用;工业上一般采用电解熔融MgCl2来冶炼镁。
本题难度:一般
3、选择题 下列实验操作、现象和解释都正确的是
选项
| 实验操作
| 现象
| 解释
|
A
| 在密闭容器中加热CuO
| 黑色固体变成红色固体
| CuO受热分解得到单质Cu
|
B
| 将SO2通入品红溶液中
| 溶液褪色
| SO2具有漂白性
|
C
| 将Mg、Al与NaOH溶液组成原电池
| Al电极溶解
| Al比Mg金属活动性强
|
D
| 向某溶液中加入盐酸酸化的氯化钡溶液
| 有白色沉淀生成
| 该溶液中一定含有SO42-
参考答案:B
本题解析:CuO受热分解生成了红色的Cu2O和O2,A错误;SO2具有漂白性,能够使品红溶液褪色,B正确;Al比Mg金属活动性弱,在Mg、Al与NaOH溶液组成原电池中,由于Al能够与NaOH溶液反应,而Mg不能,故Al电极溶解,C错误;加入盐酸酸化的氯化钡溶液,产生的白色沉淀可能是BaSO4,也可能是AgCl,故该溶液中可能含有SO42-,也可能含有Ag+,或者既含有SO42-又含有Ag+,D错误。
本题难度:一般
4、选择题 有一瓶14%的KOH溶液,加热蒸发掉100g水后,变为28%的KOH溶液80mL,该80mL溶液的物质的量浓度为
A.5?mol?L-1
B.6?mol?L-1
C.6.25?mol?L-1
D.6.75?mol?L-1
参考答案:C
本题解析:分析:根据蒸发前后溶质的质量不变,据此计算出蒸发前溶液的质量,根据质量分数计算溶质的物质的量,进而计算溶液的物质的量浓度.
解答:设14%氢氧化钾溶液的质量为x,蒸发前后溶质的质量不变,则有x×14%=(x-100g)×28%,解得x=200g,
故蒸发后溶液的质量为200g-100g=100g,
故28%的氢氧化钾溶液中含有氢氧化钾的物质的量为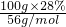 =0.5mol, =0.5mol,
所得溶液的物质的量浓度为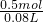 =6.25mol/L, =6.25mol/L,
故选C.
点评:本题考查物质的量浓度的计算,难度不大,注意根据溶质质量不变计算蒸发后溶液的质量为解答该题的关键.
本题难度:困难
5、选择题 除去下列括号内的杂质,所加试剂和操作均正确的是( )
| 选项 | 需除杂的物质 | 试剂 | 操作
A
Fe2O3(Al2O3)
NaOH溶液
过滤
B
CO2(HCl)
NaOH溶液
将气体通过洗气瓶
C
NaCl(Na2CO3)
稀硫酸
蒸发结晶
D
NH3(H2O)
浓硫酸
将气体通过洗气瓶
|
A.A
B.B
C.C
D.D
参考答案:A.Al2O3可与NaOH溶液反应,而Fe2O3与NaOH不反应,然后通过过滤可除去杂质,故A正确;
B.CO2和HCl都能与NaOH溶液反应,用通过饱和碳酸氢钠溶液,故B错误;
C.加入硫酸不能将杂质除去,在蒸发结晶操作较为复杂,不能得打纯净物,可用盐酸除杂,故C错误;
D.NH3和浓硫酸反应,应用碱石灰除杂,故D错误.
故选A.
本题解析:
本题难度:简单
|