1、选择题 在容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2C(g);△H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图
2C(g);△H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图

下列判断一定错误的是
[? ]
A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
参考答案:AB
本题解析:
本题难度:一般
2、选择题 在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
[? ]
A.反应混合物的浓度
B.反应体系的压强
C.正、逆反应的速率
D.反应物的转化率
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列事实不能用勒夏特利原理来解释的是( )
A.增大压强,有利于SO2和O2反应生成SO3
B.热的纯碱溶液去油污能力较强
C.加催化剂使N2和H2在一定条件下转化为NH3
D.常温下,pH=3的H2SO4溶液中水的电离程度小于pH=3的NH4Cl溶液中水的电离程度
参考答案:A.存在平衡2SO2+O2(g)?2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成SO3,能用勒夏特利原理解释,故A不选;
B.碳酸根水解CO32-+H2O?HCO3-+OH-,溶液呈碱性,水解过程是吸热过程,升高温度促进碳酸根水解,碱性增强,去油污能力增强,能用勒夏特利原理解释,故B不选;
C.催化剂能极大加快反应速率,不影响化学平衡移动,不能用勒夏特利原理解释,故C选;
D.硫酸电离出氢离子,抑制水的电离,铵根离子水解NH4++H2O?NH3?H2O+H+,促进水的电离,能用勒夏特利原理解释,故D不选;
故选C.
本题解析:
本题难度:一般
4、选择题 下列划线部分物质在充分反应后能完全消耗的有
[? ]
A.含少量CO2的1molH2与1mol Na2O2在密闭容器中,不断用电火花点燃
B.1mol MnO2与含4mol HCl的浓盐酸加热反应
C.1mol 无水C2H5OH、2mol冰醋酸与浓H2SO4混合共热
D.少量淀粉酶加入含2g淀粉的溶液中,适当温度下反应足够长的时间
参考答案:A
本题解析:
本题难度:一般
5、计算题 甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g) CO(g)+3H2(g)?△H=+206.0kJ?molˉ1
CO(g)+3H2(g)?△H=+206.0kJ?molˉ1
II:CO(g)+2H2(g) CH3OH(g)?△H=-129.0kJ?molˉ1
CH3OH(g)?△H=-129.0kJ?molˉ1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为?。
(2)将1.0mol CH4和1.0mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。
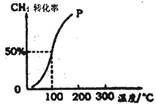
①假设100℃时达到平衡所需构时间为5min,则用H2表示该反应的平均反应速率为?。
②1000C时反应I的平衡常数为?。
(3)在压强为0.1 MPa、温度为300℃条件下,将a molCO与2a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器舶容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是?(填字母序号)。
A.平衡常数K增大
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡c(H2)/c(CH3OH)减小