1、填空题 请利用氧化还原反应Fe?+?2FeCl3?=?3FeCl2?设计一个原电池。 ?
负极:_______________正极:________________?
参考答案:负极:Fe-2e-?=?Fe2+;正极:2Fe3+?+?2e-?=?2Fe2+
本题解析:
本题难度:一般
2、选择题 将锌片和铜片用导线连接置于同一稀硫酸中,下列叙述正确的是
A.锌片是正极
B.电流方向从锌片流向铜片
C.氢气在锌片上产生
D.若锌片、铜片同时有气泡冒出,则说明锌片不纯
参考答案:D
本题解析:考查原电池
相对活泼的锌极为负极,失电子,电子经导线流向正极铜,电流方向是从铜片至锌片,氢离子在正极得电子生成氢气,排除ABC,答案为D:若锌片不纯,则可在锌片上形成微电池,也可产生气泡
本题难度:一般
3、填空题 (13分)由方铅矿(PbS)制备Pb和PbO2的方法如下:
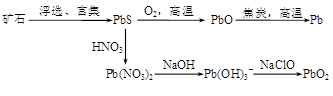
PbO与焦炭煅烧时可能会发生如下反应:
PbO(s)+C(s)=Pb(s)+CO(g)? ΔH=+108.5 kJ·mol—1? ①
PbO(s)+CO(g)=Pb(s)+CO2(g)? ΔH=-64 kJ·mol—1? ②
(1)已知Pb与O2反应的热化学方程式为:2Pb(s)+O2(g)=2PbO(s)? ΔH=-438 kJ·mol—1
则C完全燃烧的热化学方程式为?。
(2)能提高反应②中PbO转化率的措施有?(填字母)。
a.升高温度? b.增大压强? c.加入焦炭? d.加入催化剂
(3)制备过程中会产生SO2、NO、CO等有毒气体,可将它们按一定比例混合在一定条件下反应得到S、N2和CO2。若SO2与NO的体积比为1∶2,该反应的化学方程式为?。
(4)水溶液中铅的存在形态有多种,各形态的浓度分数α随溶液pH变化的关系如下图所示:
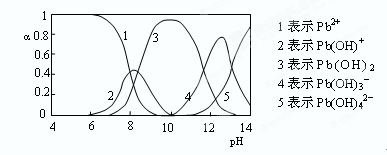
pH=6.5时,Pb2+水解的离子方程式为?;加入NaClO制备PbO2之前需先用NaOH调节溶液pH至12.5,理由是?。
参考答案:(1)C(s)+O2(g)=CO2(g)?ΔH=-393.5 kJ·mol—1?(2)c
(3)SO2+2NO+4CO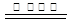 S+N2+4CO2
S+N2+4CO2
(4)Pb2++H2O Pb(OH)++H+?此时Pb(OH)3-含量最高
Pb(OH)++H+?此时Pb(OH)3-含量最高
(第(4)题每空2分,其余每空3分,共13分)
本题解析:(1)根据盖斯定律可知,①+②+③即得到C(s)+O2(g)=CO2(g) ,所以反应热ΔH=+108.5 kJ·mol—1―64 kJ·mol—1―438 kJ·mol—1=-393.5 kJ·mol—1。
(2)正反应是放热反应,升高温度平衡向逆反应方向移动,转化率降低;反应前后体积不变,改变压强平衡不移动;催化剂不能影响平衡状态;加入焦炭,能消耗CO2,降低CO2浓度,平衡向正反应方向移动,转化率增大,答案选c。
(3)根据化合价的变化可知,SO2和CO是还原剂,NO是氧化剂,所以根据电子的得失守恒可知,反应的方程式是SO2+2NO+4CO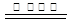 S+N2+4CO2。
S+N2+4CO2。
(4)根据图像可知,pH=6.5时,水解产物是Pb(OH)+,所以水解方程式是Pb2++H2O Pb(OH)++H+;根据图像可知,此时溶液中Pb(OH)3-含量最高,反应易于发生。
Pb(OH)++H+;根据图像可知,此时溶液中Pb(OH)3-含量最高,反应易于发生。
本题难度:一般
4、选择题 把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池.若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极.则四种金属的活泼性顺序由大到小排列为( )
A.A>C>D>B
B.A>C>B>D
C.B>D>C>A
D.A>B>C>D
参考答案:原电池中,若A、B相连时,A为负极,说明活泼性A>B,C、D相连,D上有气泡逸出,说明D做原电池的正极,C是负极,所以活泼性时C>D,A、C相连时A极减轻,所以A是负极,所以活泼性是A>C,B、D相连,B为正极,所以活泼性是D>B,总上可知金属的活泼性顺序是:A>C>D>B.
故选A.
本题解析:
本题难度:简单
5、选择题 如图所示实验中,把四根洁净的金属条A、B、C、D轮流放置在浸有盐溶液的滤纸上面并压紧。在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如下表)。下列说法中正确的是?
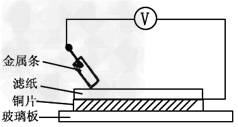
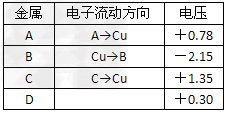
[? ]
A.金属D与Cu之间电子流动方向为Cu→D
B.A金属可能是最强的还原剂
C.B金属不能从硫酸铜溶液中置换铜
D.B金属可能是最强的还原剂
参考答案:C
本题解析:
本题难度:一般