1、填空题 高铁酸钾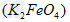 易溶于水,具有强氧化性,是一种新型水处理剂。工业上常用如下方法制备高铁酸钾:以铁丝网为阳极电解
易溶于水,具有强氧化性,是一种新型水处理剂。工业上常用如下方法制备高铁酸钾:以铁丝网为阳极电解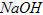 溶液,然后在阳极液中加入50%的KOH溶液,充分反应后,过滤、用异丙醇洗涤、干燥,即可制得。
溶液,然后在阳极液中加入50%的KOH溶液,充分反应后,过滤、用异丙醇洗涤、干燥,即可制得。
(1)高铁酸钾具有强氧化性的原因是___________________。
(2)用异丙醇代替水洗涤产品的好处是____________________。
(3)最近,工业上又用铁的氧化物代替铁丝网制备高铁酸盐,其优点是价廉易得且可提高电能的使用效率。则用 作阳极的电极反应式为________________;若通过相同的电流,分别用铁丝网、
作阳极的电极反应式为________________;若通过相同的电流,分别用铁丝网、 作阳极制得的高铁酸钾的质量之比为_____________。
作阳极制得的高铁酸钾的质量之比为_____________。
(4)探究高铁酸钾的某种性质。
【实验1】将适量K2FeO4固体分别溶解于pH?为?4.74、7.00、11.50?的水溶液中,配得FeO42-浓度为?1.0?mmol/L(1?mmol/L?=10-3?mol/L)的试样,静置,考察不同初始?pH?的水溶液对K2FeO4某种性质的影响,结果见图1(注:800?min后,三种溶液中高铁酸钾的浓度不再改变)。
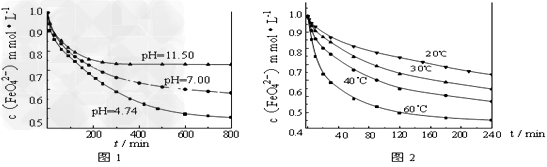
【实验2】将适量?K2FeO4溶解于pH=4.74?的水溶液中,配制成FeO42-浓度为?1.0?mmol/L的试样,将试样分别置于?20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是______________________;
②实验2可得出的结论是_____________________;
③高铁酸钾在水中的反应为4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑。由图1可知,
4Fe(OH)3+8OH-+3O2↑。由图1可知,
800?min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是_____________________。
参考答案:(1)其中的Fe元素为+6价,易得电子(或其他合理答案)
(2)减少洗涤时产品的损失且产品易干燥(或其他合理答案)
(3)Fe2O3+10OH--6e-=2FeO42-+5H2O;1∶2
(4)①研究FeO42-在不同pH溶液中的稳定性(或反应的速率);②温度越高,FeO42-越不稳定(或与水反应的速率越快);③pH=11.50的溶液中OH-离子浓度大,使平衡向左移动
本题解析:
本题难度:一般
2、选择题 工业上用洗净的废铜作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是
[? ]
A.
B.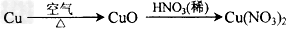
C.
D.
参考答案:B
本题解析:
本题难度:简单
3、填空题 铝粉与某些金属氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应.如:2Al+Fe2O3
2Fe+Al2O3,反应发生时放出大量的热.仔细阅读上述信息回答下列问题:
(1)“铝热反应”属于四种基本反应类型中的______反应.
(2)信息中的“某些”指______(填“比铝活泼的”“比铝不活泼的”或“任意”).
(3)试写出铝粉与MnO2发生的铝热反应方程式______.
参考答案:(1)反应的特点为一种单质和一种化合物反应生成另一种单质和另一种化合物,应为置换反应,
故答案为:置换反应;
(2)反应为置换反应,应为活泼金属置换出较不活泼金属,故答案为:比铝不活泼的;
(3)铝粉与MnO2在高温下反应生成Mn和Al2O3,反应的方程式为4Al+3MnO2?高温?.?3Mn+2Al2O3,
故答案为:4Al+3MnO2?高温?.?3Mn+2Al2O3.
本题解析:
本题难度:简单
4、简答题 工业上用铝粉还原一些金属氧化物,这类反应称为铝热反应.写出在高温下铝还原V2O5的化学方程式______,在反应中消耗了2mol铝,则转移了______mol电子.
参考答案:在高温下铝还原V2O5生成Al2O3和V,反应的化学方程式为10Al+3V2O5高温.5Al2O3+6V,
因反应中Al的化合价由0价升高到+3价,则消耗了2mol铝,则转移电子的物质的量为2mol×3=6mol,
故答案为:10Al+3V2O5高温.5Al2O3+6V;6.
本题解析:
本题难度:一般
5、填空题 (三选一)【化学—化学与技术】
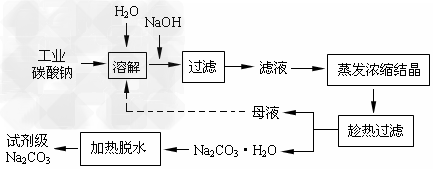
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示
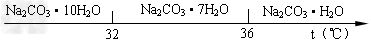
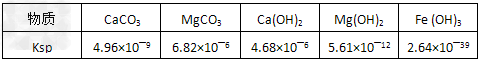
Ⅱ、25℃时有关物质的溶度积如下
回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为:______________________;25℃时,向含有
Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8?时,c(Mg2+):c(Fe3+)=?_______。
(2)“趁热过滤”时的温度应控制在__________________。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行很多次循环使用。请你分析实际工业生产中是否可行___________,并说明理由:__________________。
(4)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g)?△H=+?532.36kJ/mol
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)?△H=+?473.63kJ/mol
写出Na2CO3·H2O脱水反应的热化学方程式___________________。
参考答案:(1)Fe3++3OH-=Fe(OH)3↓,MgCO3?+2OH-=?Mg(OH)2↓+CO32-[或:Mg2++2OH-=Mg(OH)2↓];?2.?125×1021
(2)高于36℃
(3)不可行;若“母液”很多次循环使用,则溶液中的c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质
(4)Na2CO3·H2O(s)=Na2CO3(s)?+H2O(g)?△H=+58.73kJ·mol
本题解析:
本题难度:一般