1、简答题 一种“人工固氮”的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和氧气.?已知:
| 化学键 | N≡N | H-O | N-H | O=O
键能/kJ?mol-1
945
463
391
498
|
(1)请根据以上信息,写出“人工固氮”新方法的热化学方程式:______;
(2)进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3h):
| T/℃ | 30 | 40 | 50
生成NH3量/(10-6mo1/L)
4.8
5.9
6.0
|
①50℃时从开始到3h内以O2物质的量浓度变化表示的平均反应速率为______;
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢.请提出可提高其反应速率且增大NH3生成量的建议(请写出两条)______、______;
(3)氨是氮肥工业的重要原料.某化肥厂生产铵态氮肥(NH4)2SO4的工业流程如下:

①往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是______.
②煅烧炉中产生的固态副产品为______,生产流程中能被循环利用的物质X为______.
参考答案:根据题目信息,N2在催化剂表面与水蒸气发生反应生成NH3和氧气,写热化学方程式的物质变化部分为:N2+3H2O

2NH3+32O2,旧键断裂吸收的能量为:945kJ+6×463kJ=3723kJ,新键生成释放的能量为:6×391KJ+32×498KJ=3093KJ所以△H=3723kJ?mol-1-3093kJ?mol-1=+630kJ?mol-1,故答案为:N2(g)+3H2O(g)

2NH3(g)+32O2(g);△H=+630kJ?mol-1;
(2)①50℃时从开始到3h内,根据化学反应速率公式v(NH3)=△c△t=6.0×10-6mol/l3h=2.0×10-6(mol/(l?h)),氨气的反应速率和氧气的反应速率之比等于系数之比,即为4:3,故v(O2)=1.5×l0-6?mol/(L?h)(或2.5×l0-8?mol/(L?min),故答案为:1.5×l0-6?mol/(L?h)(或2.5×l0-8?mol/(L?min);
②加快化学反应速率的外界因素有升高温度、加大浓度、加大压强、使用催化剂等,对于该反应可以升高温度、增大压强,及时补充反应物等,故答案为:升高温度;增大压强;
(3)①先通入足量NH3,再通入CO2的原因是:氨在水中溶解度大,使溶液呈碱性,有利于吸收CO2,增大c(CO32-),促使CaSO4转化为CaCO3,同时生成(NH4)2SO4,故答案为:氨在水中溶解度大,使溶液呈碱性,有利于吸收CO2,增大c(CO32-),促使CaSO4转化为CaCO3,同时生成(NH4)2SO4;
②碳酸钙高温分解生成氧化钙和二氧化碳,固态副产品为CaO(或生石灰),CO2(或二氧化碳)能被循环利用,故答案为:CaO(或生石灰);CO2(或二氧化碳).
本题解析:
本题难度:一般
2、选择题 下列过程属于氮的固定的是
[? ]
A.把空气液化得到液态的氮
B.NH4HCO3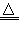 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
C.NH3+HCl=NH4Cl
D.N2+3H2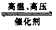 2NH3
2NH3
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列说法不正确的是( )
A.SO2在食品工业中可以用来防腐、抗氧化、漂白
B.合成氨工业需要高温高压催化剂
C.硫酸工业中用水吸收SO3
D.硫酸工业中沸腾炉排出的矿渣可供炼铁
参考答案:C
本题解析:
本题难度:一般
4、填空题 工业合成氨与制备硝酸一般可连续生产,流程如下

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)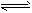 CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=________(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=________(填计算结果)。
(2)合成培中发生反应N2(g)+3H2(g)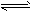 2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1_______300℃(填“>”、“<”或“=”)。
2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1_______300℃(填“>”、“<”或“=”)。

(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示。温度高于900℃时,NH3产率下降的原因_________________。

(4)在上述流程图中,氧化炉中发生反应的化学方程式为_____________________。
(5)硝酸厂的尾气含有氮的氧化物,如果不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H= -574kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_________________。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式______________,科学家利用此原理,设计成氨气--氧气燃料电池,则通入氨气的电极是________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为___________________。
参考答案:(1)1
(2)<
(3)温度高于900℃,平衡向左移动
(4)
(5)
(6)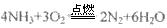 ;负极;
;负极;
本题解析:
本题难度:一般
5、填空题 利用天然气合成氨的工艺流程示意如下
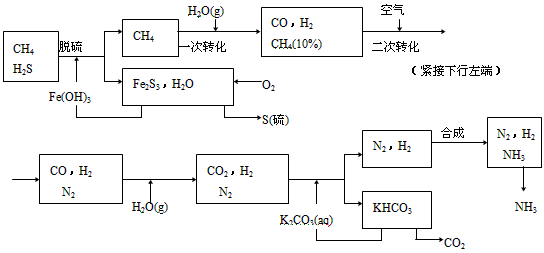
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是__________________。
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2________mol(用含n的代数式表示)
(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是_______(多选扣分)
(a)相似相溶原理 (b)勒沙特列原理(c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于________________(写出CO2的一种重要用途)
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)
参考答案:(1)3H2S+2Fe(OH)3==Fe2S3+6H2O
(2)2.7n
(3)b
(4)生产纯碱 (5)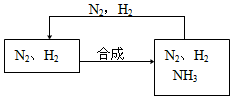
本题解析:
本题难度:一般