1、选择题 2007年10月10日,德国科学家格哈德?埃尔特生日的当天获得了诺贝尔化学奖,以奖励他在表面化学领域做出开拓性的贡献.合成氨反应在铁催化剂表面进行时效率显著提高,就是埃尔特的研究成果,下列关于合成氨反应的叙述中正确的是( )
A.铁做催化剂可加快反应速率,且有利于平衡向合成氨的方向移动
B.将氨从混合气中分离,有利于平衡向合成氨的方向移动
C.升高温度可以加快反应速率,且有利于平衡向合成氨的方向移动
D.增大压强可加快反应速率,且有利于平衡向合成氨的方向移动
2、选择题 下列说法正确的是( )
A.合成氨生产过程中高温、高压的反应条件,均可加快正反应速率,提高NH3的产率
B.硫酸工业中,为了提高SO3的吸收效率,在吸收塔内用稀H2SO4作为吸收剂
C.工业上用电解熔融AlCl3的方法制铝
D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阳极室产生的Cl2进入阴极室
3、推断题 合理设计工艺流程使资源最大化利用是目前解决资源匮乏问题的有效途径之一,如图表示某些化工生产的流程(有的反应条件和产物已略去)。
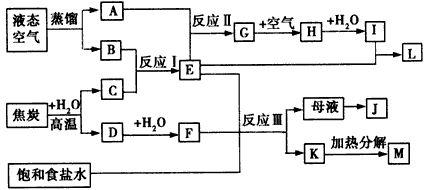
请回答下列问题:
(1)写出上述流程中所涉及的化学工业名称______________
(2)反应I需在400~500℃下进行,其主要原因是______________;H转化为I的过程中,需不断补充空气,其原因是______________
(3)写出反应Ⅲ的化学方程式________________________
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品。通氨气的作用是
_________(填序号)。
a.增大NH4+的浓度,使J更多地析出 b.使K更多地析出 c.使K转化为M,提高析出的J的纯度
4、填空题 科学家一直致力于研究常温.常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照.N2压力1.0×105 Pa.反应时间3 h):
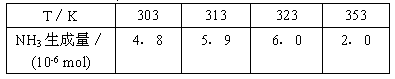
相应的热化学方程式如下: N2(g)+3H2O(1)==2NH3(g)+ O2(g) △H1=+765.2 kJ·mol-1
回答下列问题:
(1)请在下边的坐标图中,画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。

(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议:________________________________________________ 。
(3)工业合成氨的反应为N2(g)+3H2(g)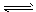 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为。计算
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为。计算
①该条件下N2的平衡转化率;
②该条件下反应2NH3(g)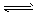 N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
5、填空题 氨广泛应用于工农业生产。
(1)工业合成氨的反应:N2(g)+3H2(g) 2NH3 ( g) △H = -a kJ . mol-1
2NH3 ( g) △H = -a kJ . mol-1
① 1/2N2(g)+3/2H2(g)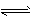 NH3(g) △H = -b kJ . mol-1
NH3(g) △H = -b kJ . mol-1
② 反应①的化学平衡常数表达式为____,a与b的关系为___(用等式表示,下 同),若分别用m、n表示反应①、②的化学平衡常数,m与n的关系为___。
(2)氨的用途之一是制备氮肥,下列化肥属于复合肥料的是___。
A.碳酸氢铵 B.尿素 C.磷酸氢二铵 D.硝酸钾
(3)氨水是一些金属离子的常见沉淀剂。
①常温下,0.01 mol/L氨水的pH =10,则一水合氨的电离平衡常数为___。
②工业废水中常含有Cr2O72- ,其有剧毒,工业处理方法一般为加入还原剂(如亚铁盐)将其还原成+3价铬,再用氨水作沉淀剂使其沉淀。常温下,Cr(OH)3的溶度积Ksp=1×10-32,要使 c( Cr3+)降至10-5 mol/L以下,溶液的pH应调至___。